Một số cơ chế kháng hóa chất của côn trùng truyền bệnh
Mục lục
- 1 Giới thiệu chung
- 2 Khái niệm
- 3 Lịch sử diễn biến kháng hóa chất
-
4
Cơ
sở
sinh
học
–
di
truyền
của
tính
kháng
hóa
chất
diệt
ở
côn
trùng
- 4.1 Tính di truyền kháng hóa chất của côn trùng
- 4.2 Các loại cơ chế kháng của côn trùng
- 5 Tài liệu tham khảo:
Giới thiệu chung[sửa]
Kháng hoá chất ở các vector truyền bệnh sẽ ảnh hưởng trực tiếp và sâu sắc tới khả năng kiểm soát các bệnh do vector truyền. Do đó việc nắm bắt các cơ chế kháng hóa hóa chất của chúng đóng vai trò quan trọng trong chiến lược sử dụng và lựa chọn hóa chất trong các biện pháp phòng chống các bệnh do vector truyền.
Khái niệm[sửa]
Kháng hóa chất (Tham khảo en:Insecticide resistance) là sự chọn lọc đặc điểm có tính kế thừa của một quần thể côn trùng gây ra thất bại một sản phẩm hóa chất hay vi:Thuốc trừ sâu mong đợi khi sử dụng theo qui định. Theo định nghĩa của WHO là sự phát triển khả năng sống sót của một số cá thể sau khi tiếp xúc với nồng độ của một hoá chất mà với nồng độ đó đa số cá thể trong một quần thể bình thường của loài đó sẽ bị chết sau khi tiếp xúc. Khả năng phát triển tính kháng hoá chất diệt phụ thuộc vào các yếu tố: sinh học, sinh thái học của côn trùng, mức độ trao đổi dòng gen giữa các quần thể, thời gian tồn lưu của hoá chất, cường độ sử dụng gồm liều lượng và thời gian sử dụng.
Lịch sử diễn biến kháng hóa chất[sửa]
Hiện tượng kháng thuốc DDT được sử dụng đầu tiên vào năm 1946, một năm sau đó (1947) trường hợp Ae.tritaeniorhynchus và Ae.solicitans đầu tiên được xác định đã kháng với DDT và vài năm sau đó tại Thụy điển DDT bị vô hiệu hóa bởi ruồi nhà Musca domestica (Perkow 1956). Tiếp sau đó hiện tượng này đã xuất hiện ở Italia, Vênêzuela, Mỹ, Nga...(Berim N.G, 1971). Đến năm 1960, đã có 130 loài chân đốt, trong đó có hơn 30 loài gây hại nông nghiệp đã có khả năng tăng sức chịu đựng (Tolerance) với các thuốc trừ sâu. Năm 1968, Tổ chức Nông – Lương Liên hiệp quốc (FAO) cho biết có 228 loài chân đốt, trong đó 125 loài gây hại trong nông nghiệp đã phát hiện tính kháng thuốc và đến năm 1976 con số này đã lên tới 346 loài (Frohlich, 1978). Đối với giống en:Anopheles, năm 1946 mới chỉ có hai loài Anopheles kháng DDT, nhưng đến năm 1991 đã có tới 55 loài kháng với 1 hoặc nhiều loại hóa chất. Trong 55 loài có 53 loài kháng với DDT, 27 loài với phốt pho hữu cơ hay organophotphorus, 17 với carbamate và 10 loài với pyrethroid, 16 loài có kháng với cả 4 loại hóa chất diệt. Có 21 loài trong 55 loài kháng là vector quan trọng đã được WHO báo cáo năm 1996. Một số kháng điển hình như: An.aconitus với DDT ở Kalimantan, Bangladesh, Ấn Độ, Nepal và Thái Lan.
Tới năm 1992, WHO công bố 72 loài muỗi kháng hoá chất, trong đó 69 loài kháng DDT, 38 loài kháng phốt pho hữu cơ, 17 loài kháng với cả 3 hoá chất trên. Sự kháng hoá chất của muỗi ngày càng tăng cả về số lượng loài lẫn mức độ kháng và một loài kháng với nhiều hoá chất. Đến năm 2000, đã có khoảng 100 loài muỗi kháng hoá chất trong đó hơn 50 loài Anopheles.
Cơ sở sinh học – di truyền của tính kháng hóa chất diệt ở côn trùng[sửa]
Tính di truyền kháng hóa chất của côn trùng[sửa]
Hiện tượng kháng hóa chất không phải là một quá trình thích nghi sinh lý của các cá thể trong quần thể.Hiện tượng này bắt nguồn từ sự sai khác tự nhiên có bản chất di truyền về mức độ mẫn cảm đối với các chất độc giữa các cá thể trong quần thể. Sự khác biệt này có sẵn trong các quần thể tự nhiên ngay từ khi chưa tiếp xúc với các loại hóa chất. Khi một quần thể côn trùng chịu áp lực của một loại hóa chất thì sẽ xảy ra một quá trình chọn lọc, những cá thể mang gen kháng hóa chất (còn gọi là gen tiền thích ứng) sẽ tồn tại. Quá trình chọn lọc này bao hàm sự thay đổi về tần số của các alen. Các gen kháng có thể có sẵn trong quần thể hoặc sinh ra do đột biến. Những cá thể trong quần thể mang gen kháng sống sót mặc dù tiếp xúc với hoá chất và truyền những gen kháng cho thế hệ sau. Khi chưa tiếp xúc với hóa chất, những gen kháng biểu hiện với tần số rất thấp, nếu được tiếp xúc thường xuyên sẽ có biến đổi trong các thế hệ tiếp theo: tần số, tỷ lệ di truyền kháng thuốc tăng dần, ban đầu là dị hợp tử, thế hệ sau là đồng hợp tử.
Việc sử dụng lặp lại một hoá chất sẽ loại bỏ các cá thể nhạy và tỷ lệ các cá thể kháng sẽ tăng và cuối cùng số cá thể kháng sẽ trội lên trong quần thể. Nếu trong một quần thể tỷ lệ các cá thể mang gen kháng là 1/10.000, nếu tiếp xúc liên tục với hóa chất thì qua 15 thế hệ liên tục thì tỷ lệ kiểu di truyền kháng thuốc sẽ tăng lên 1/30 và sau 7 thế hệ nữa (22 thế hệ) tỷ lệ kiểu di truyền kháng thuốc trong quần thể này tăng tới 1/1.
Các loại cơ chế kháng của côn trùng[sửa]
Các hóa chất có thể xâm nhập vào cơ thể muỗi bằng nhiều cách và ảnh hưởng đến sự sống sót của chúng ở mức độ khác nhau. Dựa vào khả năng hóa chất bị phân giải trực tiếp hay không khi tác động lên cơ thể muỗi để chia ra các loại cơ chế:
Kháng do cơ chế chuyển hóa (metabolic mechanism)[sửa]
Trong cơ chế này khi phân tử hóa chất diệt xâm nhập vào cơ thể, dưới tác dụng của các enzym khác nhau trong cơ thể muỗi kháng thuốc nó sẽ bị phân giải theo nhiều con đường khác nhau như: oxy hóa, thủy phân, hydro hóa, khử clo, ankyl hóa... trở thành chất không độc. Có 3 nhóm enzyme đóng vai trò chính trong cơ chế côn trùng kháng các nhóm thuốc Chlor hữu cơ, Phốt pho hữu cơ, Carbamat và Pyrethroides.
- Men Esterase thường liên quan đến cơ chế chuyển hóa trong nhóm Phốt pho hữu cơ, Carbamat, nhưng ít có tác dụng đối với nhóm pyrethroid. Hai locus est α và est β của Esterase hoặc đơn lẻ hoặc phối hợp trong cơ chế kháng thuốc của giống Culex.
- Men DDT dehydrochorinase như là Glutathione S-transferase (GSTs) kháng DDT ở ruồi nhà Musca domestica, Anopheles và Aedes, men này khử clo của phân tử DDT, chuyển DDT thành DDE là hợp chất không có tính độc cho với côn trùng . Có 2 lớp GSTs và cả 2 đều có vai trò trong cơ chế kháng hóa chất của côn trùng. Ở Ae.aegypti có ít nhất 2 loại GST gia tăng trong kháng DDT, trong khi đó An.gambiae thì có rất nhiều GSTs khác nhau gia tăng, trong đó có vài loại thuộc GSTs lớp I.
- Men Monooxygenases liên quan đến sự chuyển hóa của nhóm Pyrethroids, hoạt hóa hoặc khử oxy trong nhóm Phốt pho hữu cơ, nhưng ít có tác dụng đối với nhóm Carbamate. Nó là những phức hợp men đóng vai trò trong chuyển hóa chất sinh học lạ (xenobiotics) và trong chuyển hóa nội sinh (endogenous metabolism). Các men Monooxygenases P450 đóng vai trò quan trọng trong việc thích nghi với hóa chất của côn trùng. Sự gia tăng của men này có liên hệ chặt chẽ với sự kháng hóa chất nhóm Pyrethroid của An.stephensi, An.subpictus, An.gambiae và C.quinquefasciatus
Cơ chế này tạo ra một mức độ kháng mạnh mẽ nhất của muỗi đối với từng loại hóa chất. Sự kháng là kết quả của sự thay đổi về mặt cấu trúc enzym làm tăng khả năng giải độc của nó hoặc tăng số lượng enzym dẫn đến tăng sự đào thải độc tố hoá chất diệt côn trùng ra khỏi cơ thể chúng.
A. Đột biến ở một axit amin trong vùng trải trên màng IIS6 của gen kênh vận chuyển Na+ đã tạo ra tính kháng DDT – pyrethroid ở Anopheles gambiae. Cũng codon bị đột biến đó đã tạo ra tính kháng rất phong phú ở côn trùng.
B. Nhân tố điều hòa (phía trên trình tự mã hóa) còn gọi là “hộp Barbie” cho phép cảm ứng các gen kháng mã hóa Esterase và Oxidase phân hủy thuốc diệt côn trùng. Nhiều các nhân tố điều hòa giả thiết này đã được tìm ra là có liên quan đến các ezyme kháng ở vector.
C. Đơn vị siêu sao chép A2-B2 Esterase. Các gen Esterase kháng này nằm ở đầu 5’ tới đầu 5’ trong cùng một đơn vị khuyếch đại. Hơn 100 bản sao của đơn vị siêu sao chép này có thể xuất hiện trong cùng một con muỗi. Đây chỉ là một ví dụ của một họ các gen Esterase được khuyếch đại.
Kháng do giảm tính thẩm thấu[sửa]
Là cơ chế mà trong đó hóa chất diệt không bị phân hủy trực tiếp, song tính kháng hình thành là do giảm khả năng thấm. Nhiều loại hoá chất diệt côn trùng thâm nhập vào cơ thể côn trùng qua lớp biểu bì. Những thay đổi của lớp biểu bì của côn trùng làm giảm tốc độ thẩm thấu của hoá chất diệt côn trùng gây nên sự kháng đối với một số hoá chất diệt. Đơn thuần tính thấm giảm chỉ gây ra sự kháng ở mức độ thấp.
Kết quả nghiên cứu cơ chế kháng thuốc DDT của ruồi nhà đã chứng minh: Ruồi kháng DDT có lớp cutin dày hơn, khó thấm DDT hơn những so với ruồi mẫn cảm DDT. Tác giả Otto.D (1976) cũng đã nêu lên sự thay đổi về cấu tạo của Lipoid, sáp và protein trong cutin hoặc gia tăng kết cứng biểu bì của những côn trùng kháng thuốc.
Pery. A.S và Agosin. M (1974) cũng cho rằng những quần thể côn trùng kháng hóa chất đã xuất hiện một lớp Lipid có tác dụng ngăn cản sự xâm nhập của hóa chất vào cấu trúc tinh tế của hệ thần kinh, làm cho thuốc mất tác dụng. Cơ chế này hiếm khi được đề cập tới, nó thường được coi là thứ yếu thậm chí không được nhắc tới ở muỗi. Tuy nhiên, nếu phối hợp với các cơ chế kháng khác, nó có thể tạo nên sự kháng cao. Cơ chế này hầu hết được phát hiện qua các nghiên cứu tính thấm sử dụng hoá chất diệt đánh dấu.
Kháng do biến đổi vị trí đích (Target-Site Resistance)[sửa]
Sự kháng này gây ra bởi sự biến đổi vị trí đích tác động của hoá chất diệt côn trùng. Sự biến đổi đó đã được quan sát thấy ở các enzym và cơ quan cảm nhận thần kinh, đó là điểm đích của một số lớp hoá chất diệt côn trùng. Có 3 hình thức kháng hoá chất diệt côn trùng bằng cách thay đổi vị trí đích nhạy cảm.
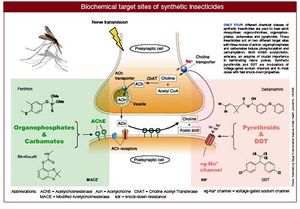
Kháng kdr (Knockdown Resistance) hay kháng liên quan đến vai trò các kênh Na+[sửa]
Kháng kdr liên quan đến các đột biến gen tổng hợp các protein có vai trò vận chuyển natri qua màng ở một số loài côn trùng. Các hoá chất DDT và Pyrethroid làm thay đổi động học của các kênh vận chuyển natri có vai trò trong sự truyền các xung thần kinh Có hai dạng đột biến kdr khác nhau đã được phát hiện ở muỗi An. gambiae ở châu Phi. Ở Đông Phi, kháng kdr liên quan đến một đột biến dẫn tới kết quả là một leucine được thay thế bởi một phenylalanin ở mảnh S6 thuộc domain thứ 2 của alen kdr (L1014F). ở Kenya một dạng đột biến khác cũng được tìm thấy, đó là đột biến thay thế leucine bằng serine ở vị trí tương tự (L1014S). Sự kháng chéo đối với DDT và pyrethroidlà một chỉ thị của sự kháng kdr và thường nó có tính lặn di truyền.
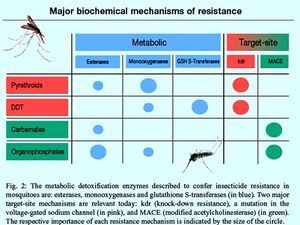
Metabolic: enzyme liên quan tính kháng ở muỗi là: esterases, monooxygenases, GSH S-Transferases.
Target-site: hai cơ chế kháng vị trí đích
Kdr (kháng hạ gục): đột biến trên gen kdr
MACE: enzyme acetylcholinesterase đã bị biến đổi
Tầm quan trọng tương ứng của mỗi một cơ chế kháng được biểu thị bởi kích thước của những chấm tròn.
Hiện tượng trơ hoặc thay đổi men Acetylcholinesterase (MACE: Modified acetylcholinesterase)[sửa]
Men Acetylcholinesterase (AchE) của côn trùng liên quan đến việc kháng hóa chất nhóm Phốt pho hữu cơ và Carbamate. AchE thủy phân chất dẫn truyền thần kinh Acetylcholine trên màng synap sau của tế bào thần kinh. Trong muỗi C.pipiens có sự gia tăng2 loại men AchE 1 và AchE 2, tuy nhiên chỉ có AchE 1 có vai trò trong kháng hóa chất của muỗi này. Men AchE bị biến đổi về độ mẫn cảm cũng khiến cho ruồi, ve, mò... không những chỉ chống với một loại hóa chất mà có thể cùng một lúc chống được nhiều loại hóa chất thuộc 2 nhóm trên (Hama.H và Iwata.T, 1971).
Kháng do thay đổi thụ thể (receptors) GABA (G-Amino Butyric Acid)[sửa]
GABA là thụ thể thuộc nhóm các thụ thể dẫn truyền thần kinh. Những thụ thể này được hình thành bởi 5 tiểu đơn vị (subunits) xung quanh kênh dẫn truyền ion. Thụ thể GABA của côn trùng là điểm tác động của nhóm thuốc Pyrethroid, Chlor hữu cơ (Cyclodiene) và chế phẩm Avermectin. Cơ chế kháng là do sự thay đổi một nucleotit trong một bộ ba mã hoá của gen tổng hợp nên thụ thể, qua đó làm giảm độ nhạy của thụ cảm thể đối với hiệu lực độc của hoá chất diệt côn trùng. Các nghiên cứu cũng cho thấy rằng các côn trùng kháng hóa chất Cyclodiene có khả năng ly giải độc chất Picrotoxin cũng như Phenylpyrazole và làm giảm hiệu lực của Ivermectin (Avermectin) liên quan đến vai trò của các thụ thể GABA.
Kháng tập tính (behaviouristic resistance)[sửa]
Đó là sự thay đổi của côn trùng trong tập tính né tránh được liều chết của hóa chất. Những thay đổi bao gồm sự giảm xu hướng bay vào vùng sử dụng hoá chất hay tránh xa khỏi bề mặt có hoá chất. Tuy nhiên, sự kháng này cũng hiếm khi được đề cập đến và giống như hậu quả thay đổi gây ra trực tiếp bởi sự có mặt của hoá chất diệt côn trùng hoặc do những con muỗi sống trong nhà của quần thể muỗi bị tiêu diệt.
Tính đa kháng[sửa]
Là hiện tượng kháng có hai hoặc nhiều cơ chế kháng trong cùng một cá thể côn trùng (Multiresistance). Cơ chế kháng này đang phát triển rất nhanh, nó được tạo ra trong quá trình áp dụng liên tiếp lớp hoá chất này sau lớp hoá chất kia của các chương trình phòng chống sốt rét.
Tình trạng đáp ứng với hóa chất diệt của một số loài Anopheles tại Việt Nam.
Hiện nay, các hoá chất thuộc nhóm pyrethroid (alphacypermethrin, lambdacyhalothrin, deltamethrin, permethrin, Etofenprox…) đang được sử dụng rộng rãi trong chương trình phòng chống sốt rét ở nhiều nước trên thế giới trong đó có Việt Nam. Sự phát triển tính kháng của vector sốt rét với các hoá chất này có thể gây trở ngại cho sự thành công của hoạt động phòng chống sốt rét. Tuy nhiên, tính kháng pyrethroid đang biểu hiện rõ dần bất chấp sự lạc quan ban đầu cho rằng lớp hoá chất diệt côn trùng mới và lớn này sẽ không tạo nên tính kháng vì hoạt động gây độc nhanh của nó. Tại Guatemala, sự kháng pyrethroid lần đầu tiên được ghi nhận ở một quần thể An. albimamus đã kháng với fenitrothion. Khi deltamethrin được sử dụng, esterase đóng vai trò trong sự kháng fenitrothion đã được tăng cường do áp lực chọn lọc tạo ra tính kháng chéo với deltamethrin. Hơn thế nữa, người ta đã tìm ra sự kháng chéo DDT-permethrin là do Oxidase trong cùng một cá thể muỗi. Một kiểu tương tự của tính kháng chéo đã được phát hiện đối với C. pipiens ở Ohio.
Tại Việt Nam, một số kết quả nghiên cứu mức độ nhạy cảm với hoá chất nhóm pyrethroid cũng đã được công bố. Theo Nguyễn Tuấn Ruyện (1997), một số quần thể An. minimus ở Gia Lâm (Hà Nội), Khánh Vĩnh (Khánh Hoà), An. jeyporiensis ở Võ Nhai (Bắc Thái); An. aconitus, An. philippinensis ở Chiêm Hoá (Tuyên Quang), An. aconitus ở Na Hang (Tuyên Quang), An. sinensis ở Sóc Trăng đã tăng mức chịu đựng (có khả năng kháng) với pyrethroid.
Tài liệu tham khảo:[sửa]
- Đào Minh Trang (2008), Nghiên cứu hoạt tính một số enzym liên quan đến tính kháng hóa chất diệt côn trùng ở muỗi Anopheles minimus phân bố tạimiền Bắc Việt Nam, Luận văn Thạc sỹ Sinh học, trường Đại học Khoa học Tựnhiên, Đại học Quốc gia Hà Nội.
- Đỗ Thị Diễm Trinh (2008), Bước đầu nghiên cứu tính kháng hóa chất diệt của loài muỗi truyền bệnh sốt xuất huyết Aedes aegypti Linnaeus, 1762 ở quận Đống Đa, Hà Nội bằng kỹ thuật PCR, Luận văn tốt nghiệp hệ đào tạo cử nhân tài năng trường Đại học Khoa học Tựnhiên, Đại học Quốc gia Hà Nội.
- Hồ Viết Hiếu (2010) - Nghiên cứu tính kháng thuốc ở một số loài muỗi truyền bệnhtại Việt Nam. Luận văn Thạc sỹ khoa học sinh học, Trường Đại học Khoa học tự nhiên Hà Nội.
- Lương Thị Liên (2002), Nghiên cứu tính kháng thuốc trừ sâu và hiện tượng đa hình enzym Esterase của ba quần thể sâu tơ ở ngoại thành Hải Phòng, Luận văn Thạc sỹ Sinh học, Trường Đại học Sư Phạm Hà Nội.
- Nguyễn Thị Thu Hoài (2003), Nghiên cứu sự biểu hiện izozym ở các quần thể muỗi Aedes aegypti tại một số vùng của Việt Nam, Luận văn tốt nghiệp hệ đào tạo cử nhân tài năng trường Đại học Khoa học Tựnhiên, Đại học Quốc gia Hà Nội.
- Nguyễn Tuấn Ruyện, Trần Đức Hinh. Lê Đình Công, Lê Khánh Thuận, Phạm Xuân Đỉnh,…và ctv, (1997), “Kết quả theo dõi sự kháng hoá chất diệt côn trùng ở các loài muỗi truyền bệnh sốt rét ở Việt Nam 1992-1995”, Kỷ yếu công trình nghiên cứu khoa học, NXB Y học, tr. 401-406.
- Trần Đức Hinh, Nguyễn Đức Mạnh, Hồ Đình Trung, Nguyễn Tuyên Quang, Lê Xuân Hợi, trịnh Đình Đạt, Nguyễn Thị Hương Bình, Nguyễn Văn Quyết, Nguyễn Văn Đồng, Nguyễn Thị Điệp, Đoàn Thị Kiềm, Vũ Đức Chính, Nguyễn Đình Lựu, Phạm thị Vưu, Vũ Khắc Đệ, Vũ Khắc Chinh (2001), “Nghiên cứu điện di isozyme và di truyền tế bào của Anopheles minimus và An. dirus ở Việt Nam”, Kỷ yếu công trình nghiên cứu khoa học 1996-2000, Viện Sốt rét-KST-CTTƯ, NXB Y học, tr. 379-387.
- Trịnh Đình Đạt, Nguyễn Thị Minh Nguyệt (2002), “ứng dụng phương pháp phân tích izozym trong nghiên cứu đa dạng sinh học và phân loại sinh học”.
- Trịnh Đình Đạt, Trương Quang Học, Ngô Giang Liên (1991), “Nghiên cứu một số hệ isozym ở nhóm loài muỗi sốt rét Anopheles minimus, Theobal, 1901 (diptera culicidae) ở Việt Nam”, Hội nghị côn trùng học quốc gia Việt Nam lần thứ nhất, Hà Nội, tr. 47.
- Trịnh Đình Đạt, Vũ Thị Loan, Tạ Toàn. Xác định mức độ và đặc điểm di truyền tính kháng thuốc của muỗi Culex quiquefasciatus. Tạp chí di truyền học và ứng dụng số 1-1993, tr 26-27.
- Vũ Thị Loan (1989)– Bước đầu nghiên cứu khả năng kháng thuốc diệt ở một số quần thể muỗi Culex quinquefasciatus thuộc khu vực Hà Nội – Hà Đông . Luận văn Thạc sỹ Khoa học sinh học, Trường Đại học sư phạm Hà Nội 1989.
- Brogdon W.G., Barber AM., (1990), “Fenitrothion-deltamethrin cross-resistance conferred by esterases in Guatemalan Anopheles albimanus” Pesticide Biochemistry and Physiology, 37, pp.130-139.
- Claudianos, C., R. J. Russell, and J. G. Oakeshott. “The Same Amino Acid Substitution in Orthologous Esterases Confers Organophosphate Resistance o¬n the House Fly and a Blowfly.” Insect Biochemistry and Molecular Biology 29 (1999): 675–686.
- Denholm, I., J. A. Pickett, and A. L. Devonshire, eds. Insecticide Resistance: From Mechanisms to Management. London, 1999.
- French-Constant, R. H., N. Anthony, K. Aronstein, T. Rocheleau, and G. Stilwell. “Cyclodiene Insecticide Resistance: From Molecular to Population Genetics.” Annual Review of Entomology 48 (2000): 449–466.
- Gahan, L. J., F. Gould, and D. G. Heckel. “Identification of a Gene Associated with Bt Resistance in Heliothis virescens.” Science 293 (2001): 857–860.
- Georghiou, G. P., and A. Lagunes-Tejeda. The Occurrence of Resistance to Pesticides in Arthropods. Rome, 1991.
- Gould, F. “Sustainability of Transgenic Insecticidal Cultivars: Integrating Pest Genetics and Ecology.” Annual Review of Entomology 43 (1998): 701–726.
- Groeters, F. G., and B. E. Tabashnik. “Roles of Selection Intensity, Major Genes, and Minor Genes in Evolution of Insecticide Resistance.” Journal of Economic Entomology 93 (2000): 1580– 1587. Reviews empirical estimates of selection intensity and simulates various genetic models to test theories about resistance.
- Hemingway, J., and H. Ranson. “Insecticide Resistance in Insect Vectors of Human Disease.” Annual Review of Entomology 45 (2000): 371–391.
- Ho Dinh Trung, (2003), Malaria vetors in Southeast Asia: Identification, Malaria transmission, Behavior and Control, Dissertation for the degree of Doctor in Science at the University of Antwerp.
- James A. Ferrary, (1996), ‘’Insecticide resistance’’ The Biology of Disease Vectors, pp. 512-516.
- Lee H.L, (1990), “A rapid and simple biochemical method for the detection of insecticides resistance due to elevated esterased activity in Culex quinquefasciatus”, Trop. Biomed. 7: 21-28.
- Martinez-Torres D, Chandre F, Williamson MS, Darriet F, Berge JB, Devonshire AL, et al, (1998), “Molecular characterization of pyrethroid resistance in the malaria vector Anopheles gambiae”. Insect Molecular Science.
- Oppenoorth FJ., (1985), “Biochemistry and genetics of insecticide resistance”. In: Comprehensive insect physiology,biochemistry and pharmacology (Kerkut GA and Gilbert LI, eds). Oxford: Pergamon Press, pp. 731–773.
- Rodriguez M.M., Bisset J. Ruiz M., Soca A., (2000), “Cross-reistance to pyrethroid and organophosphate insecticides, selection with temephos in Aedes aegypti in Cuba”.
- Rosenheim, J. A., M. W. Johnson, R. F. L. Mau, S. C. Welter, and B. E. Tabashnik. “Biochemical Preadaptations, Founder Events, and the Evolution of Resistance in Arthropods.” Journal of Economic Entomology 89 (1996): 263–273. Tests evolutionary hypotheses about resistance using an extensive database o¬n crop pests.
- Roush, R. T., and B. E. Tabashnik, eds. Pesticide Resistance in Arthropods. New York, 1990.
- Tabashnik, B. E., and M. W. Johnson. “Evolution of Pesticide Resistance in Natural Enemies.” In Handbook of Biological Control, edited by T. Fisher, T. S. Bellows, L. E. Caltagirone, D. L. Dahlsten, C. Huffaker, and G. Gordh, pp. 673–689. San Diego, 1999. Analyzes evolutionary hypotheses and evidence about the scarcity of resistance in arthropod predators and parasitoids.
Ngày 10/01/2011 Người tổng hợp: CN. Hồ Đắc Thoàn và ThS. Hồ Viết Hiếu, IMPE Quy Nhơn




