Lectin
Mục lục
Lectin[sửa]
Định nghĩa[sửa]
Lectin là một loại protein không có nguồn gốc miễn dịch có khả năng liên kết thuận nghịch, phi hóa trị với carbohydrate mà không thay đổi cấu trúc của carbohydrate được liên kết. Lectin gắn kết với những tế bào có glycoprotein hoặc glycolipid bề mặt. Sự hiện diện của hai hay nhiều vị trí gắn kết đối với mỗi phân tử lectin cho phép nó gắn kết nhiều loại tế bào và phản ứng gắn kết với hồng cầu được sử dụng rất rộng rãi để kiểm tra sự hiện diện của lectin trong dịch chiết từ các sinh vật khác nhau.
Lectin được phát hiện ở gần như tất cả các sinh vật ở mọi cấp bậc phân loại từ virus đến vi khuẩn đến động vật có xương sống, và có lẽ nó có ở mọi sinh vật sống. Một sinh vật có thể có nhiều loại lectin gần gũi nhau hiện diện ở các mô khác nhau (ví dụ ở đậu Dolichos biflorus). Mặt khác ở một cơ quan cũng có thể có nhiều loại lectin khác nhau, ví dụ ở gan chuột có thụ thể asialoglycoprotein, protein liên kết glucosamine, protein liên kết fucose.
Lược sử nghiên cứu[sửa]
Cho đến những năm cuối của thế kỷ 19 bắt đầu có sự tích lũy lớn bằng chứng về sự hiện diện của một loại protein có khả năng ngưng kết hồng cầu trong tự nhiên. Những protein như vậy được đề cập dưới tên gọi là hemagglutinins hay agglutinins thực vật (phytoagglutinins) vì ban đầu chúng được tìm thấy ở mẫu chiết từ thực vật. Phần lớn đều cho rằng mô tả đầu tiên về một hemagglutinin như vậy là từ Peter Hermann Stillmark trong luận án tiến sĩ vào năm 1888 nộp lên trường đại học Dorpat (hiện nay là ĐH Tartu, Estonia), một trong những trường đại học lâu đời nhất dưới thời nước Nga Sa Hoàng. Chất hemagglutinin được Stillmark tách chiết từ hạt của cây thầu dầu Ricinus communis và được đặt tên là ricin. Sau đó H. Hellin, cũng ở ĐH Tartu cho thấy sự hiện diện của một hemagglutinin độc, gọi là abrin ở mẫu chiết của cây đậu Abrus precatorius. Ngay lập tức ricin và abrin được thương mại hóa, khiến Paul Erlich ở Royal Institute of Experiemental Therapy (Frankfurt) sử dụng chúng làm kháng nguyên mô hình cho các nghiên cứu miễn dịch. Mặc dù các mẫu mà ông có khá thô so với các tiêu chí hiện nay (ricin và abrin mỗi loại đều chứa một chất ngưng kết yếu nhưng có độc tính mạnh và một chất độc yếu nhưng có tính ngưng kết mạnh, tất cả đều đặc hiệu với galactose) nhưng với chúng ông vẫn có thể xây dựng một số nguyên lý cơ bản về miễn dịch học vào những năm 1890. Như vậy Ehrlich phát hiện ra rằng chuột được miễn dịch với liều ricin hoặc abrin gây chết bằng cách tiêm lặp lại các liều nhỏ (dưới ngưỡng gây chết) các lectin này và chất kháng ricin không bảo vệ được con vật đối với độc tính của abrin cũng như chất kháng abrin không bảo vệ được con vật chống lại ricin. Kết quả này cung cấp bằng chứng rõ ràng cho tính đặc hiệu của các đáp ứng miễn dịch. Ehrlich cũng chứng tỏ được rằng tính miễn dịch đối với các độc tố được truyền từ mẹ sang con bằng đường máu trong quá trình mang thai và trong quá trình cho con bú sau khi sinh. Bằng cách nghiên cứu hiệu ứng ức chế của huyết thanh anti-ricin đối với hoạt tính ngưng kết cuả ricin, ông đã chứng minh đươcj răngf có một mối quan hệ định lượng giữa lượng kháng huyết thanh và lượng kháng nguyên mà nó có thể trung hoà và dựa trên cơ sở này thực hiện việc định lượng đầu tiên đối với kháng thể in vivo. Những nghiên cứu này đã chứng minh tính đặc hiệu của đáp ứng miễn dịch, hiện tượng ghi nhớ miễn dịch và sự truyền miễn dịch thể dịch từ mẹ sang con.
Công chúng biết tới ricin vào năm 1978 theo sau việc sử dụng nó làm vũ khí ám sát bằng dù tai tiếng mang đầy động cơ chính trị đối với nhà văn bất mãn chế độ người Bulgari Georgi Markov đang đi đày.Các ý định sử dụng ricin làm vũ khí đã được tiến hành bởi USA trong Đại chiến thế giới thứ I; trong Đại chiến thế giới thứ II bom ricin đã được sản xuất và thử nghiệm bởi quân đội Anh nhưng nó không bao giờ được sử dụng làm vũ khí hủy diệt hàng loạt. Gần đây ricin đã có mặt trong kho vũ khí của các phần tử, nhóm & chính phủ cực đoan.
Năm 1919, James B. Summer ở đại học Cornell (Ithaca, New York), nổi tiếng vì là người đầu tiên kết tinh được một enzyme vào năm 1926 (nhờ đó được tặng giải Nobel 21 năm sau), là người đầu tiên tinh sạch được từ đậu rựa (Canavalia ensiformis) một protein tinh thể mà sau đó được đặt tên là concanavalin A. Các công trình tiếp theo của Sumner và Howell (1936)về khả năng ngưng kết hồng cầu và nấm men của concanavalin A, William C. Boyd và Karl O. Renkonen (1940s) về tính đặc hiệu của lectin ở đâu lima (Phaseolus limensis) và đậu tằm (Vicia cracca), Walter J. T. Morgan và Winifred M. Watkins về sự ức chế hoạt tính lectin bởi các loại đường khác nhau đã giúp đưa ra bằng chứng về tính đặc hiệu với hồng cầu các nhóm máu ABO của lectin và khẳng định sự hiện diện của các phân tử đường trên bề mặt hồng cầu.
Những kết quả ban đầu của Stillmark cũng đã nói lên một phần tính đặc hiệu của hiện tượng ngưng kết bởi ricin đối với hồng cầu của các động vật khác nhau. Sự quan sát này được củng cố và mở rộng thêm bởi Karl Landsteiner ở đại học Vienna, người khám phá ra các nhóm máu người A, B và O vào năm 1900. Gần một thập kỷ sau ông công bố rằng các hoạt tính ngưng kết của các chất chiết từ các hạt khác nhau thì khác nhau khi thử nghiệm trên hồng cầu của các động vật khác nhau (Landsteiner & Raubistchek, 1907). Vì tính đặc hiệu này Landsteiner kết luận rằng hoạt động của chất ngưng kết có nguồn gốc thực vật này “về cơ bản giống như kháng nguyên”. Vì vậy ông đã sử dụng những protein này để minh họa cho khái niệm tính đặc hiệu trong chương mở đầu của cuốn sách kinh điển “Tính đặc hiệu của các phản ứng huyết thanh” (1936).
Khả năng phân biệt giữa các hồng cầu của các nhóm máu khác nhau của các agglutinin thực vật khiến Boyd và Shapleigh (1954) đề xuất cho chúng một cái tên là lectin, từ tiếng Latin legere, có nghĩa là chọn ra. Thuật ngữ này được tổng quát hóa để bao gồm tất cả các agglutinin đặc hiệu với các phân tử đường không có nguồn gốc miễn dịch, bất kể chúng có nguồn gốc từ đâu hoặc đặc hiệu với các nhóm máu như thế nào.
Lectin thực vật được nghiên cứu rộng rãi theo hướng điều tra và thăm dò tính đặc hiệu cho đến đầu những năm của thập kỷ 70. Ở thời điểm đó người ta đã nghiên cứu được rất nhiều lectin mà chủ yếu tập trung ở họ Đậu. Các lectin động vật ít thu hút được sự chú ý và chỉ có một số nghiên cứu về lectin ở chạch, sên và cua móng ngựa là được nghiên cứu kỹ. Lectin quan trọng nhất ở động vật được khám phá chính là thụ thể asialoglycoprotein gan động vật có vú đặc hiệu với galactose được phát hiện bởi G. Ashwell và G. Morell vào năm 1974. Thụ thể này tham gia vào quá trình nhận diện và loại bỏ các glycoprotein già cỗi trong máu, qua đó kiểm soát chu trình sống của các glycoprotein trong máu.
Cấu trúc của lectin được nghiên cứu mạnh mẽ vào thập kỷ 70 nhưng tiến triển với tốc độ khá chậm cho đến khi kỹ thuật tái tổ hợp ra đời. Ngày nay người ta có thể tiến hành giải trình tự của lectin rồi giải đoán cấu trúc bậc ba của nó dựa trên tính tương đồng của các lectin cùng họ. Tuy nhiên nhiều lectin đã được giải đoán cấu trúc bậc ba mà không cần thông qua trình tự bậc một nhờ vào kỹ thuật chụp ảnh tinh thể tia X. Hiện nay đã có tới hơn 200 lectin được giải đoán cấu trúc (xem ở đây)
Phân bố và phân loại[sửa]
Ở thực vật có hơn 1000 loài được phát hiện là có hoạt tính lectin, tuy nhiên người ta mới chỉ biến rõ 4-5% lectin ở những họ thực vật có hoa. Hơn nữa các lectin được mô tả rõ nhất đều thuộc họ Đậu và chúng chiếm 60% các lectin được nhiều người biết đến. Lectin được phát hiện thấy ở hầu hết các mô thực vật, nhưng sự phân bố của chúng trong các mô thay đổi theo các họ đã được nghiên cứu. Chúng có nhiều ở hạt (họ Đậu, họ Đại Kích, Hòa Thảo), quả và củ (họ Cà, họ Hành), rễ (họ Bầu Bí, họ Đậu) và ở chồi và lá (Họ Xương Rồng và họ Lan).
Lectin động vật cũng đã được mô tả ở một số nhỏ đối tượng mặc dù chúng được phát hiện ở hầu hết các sinh vật có xương sống lẫn không xương sống. Lectin ở sinh vật không xương sống có chủ yếu ở dịch hoặc dịch tiết, ví dụ huyết thanh cá, nọc rắn, tinh dịch, huyết tương. Lectin ở động vật có xương số tồn tại ở dạng tự do hoặc protein cấu trúc màng ở dịch phôi, các cơ quan và mô ở cơ thể trưởng thành.
Lectin vi sinh vật đã được tinh sạch chủ yếu từ vi khuẩn nhưng chúng cũng được phát hiện thấy ở virus, nấm meo, trùng roi, nấm mốc, tảo lục. Trong nhiều trường hợp lectin vi sinh vật gắn vào bề mặt vi khuẩn và chỉ có một vị trí nhận diện. Lectin vi sinh vật giúp chúng gắn kết các tế bào lại với nhau nhưng lectin cô lập từ vi sinh vật lại không có hoạt tính này và vì vậy chúng được gọi là các protein giống lectin.
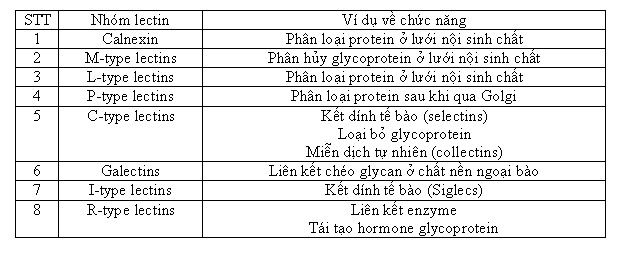
Dựa vào cấu trúc & tính đặc hiệu với các loại đường khác nhau của vùng nhận diện carbohydrate (CRD-Carbohydrate Recognition Domain)người ta phân lectin động vật thành một số loại sau:
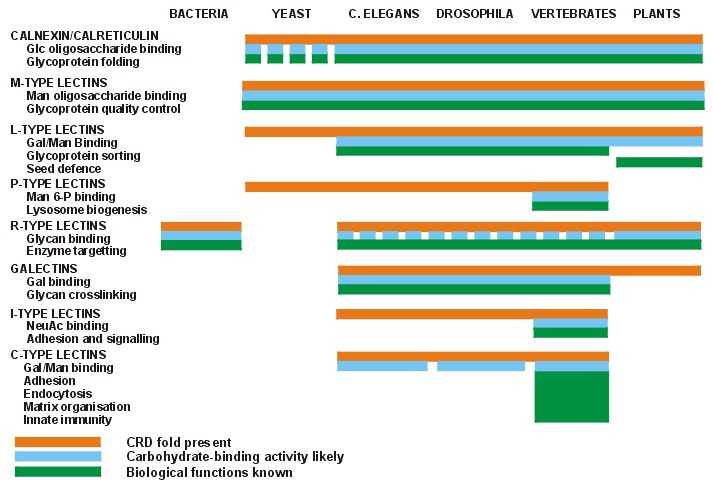
Quan hệ tiến hóa của các lectin từ vi khuẩn đến động vật xương sống được mô tả như sau:
Tính chất phân tử[sửa]
Mặc dù hiện tượng gắn kết các phân tử đường là như nhau ở các sinh vật, không có gì ngạc nhiên khi cấu trúc của lectin ở các loài khác nhau khác nhau một cách rõ rệt. Điều này là hiển nhiên vì thực vật, động vật và vi sinh vật đã tiến hóa theo các hướng khác nhau trong một thời gian dài. Các phân tử gắn kết các gốc đường dường như đã xuất hiện ở các thời kỳ khác nhau và là sản phẩm của các quá trình tiến hóa khác nhau. Tuy nhiên trong mỗi ngành thường có sự giống nhau về cấu trúc, thông thường là do sự tương đồng về trình tự của một số đoạn polypeptide trong các tiểu đơn vị. Ví dụ các lectin họ Đậu đều được cấu tạo từ những tiểu đơn vị có cấu trúc bậc ba rất giống nhau dù cấu trúc bậc một của chúng hơi khác nhau. Motif cuộn lỏng lẻo (jelly-roll) gồm tấm β sáu chuỗi ở phía sau, một tấm β năm chuỗi phía trên và một tấm β bảy chuỗi ở phía trước cùng với các vòng lặp nối các tấm này lại với nhau (xem hình)
Chú thích: Cấu trúc gấp điển hình của một tiểu đơn vị lectin họ đậu đang liên kết với một phân tử lactose. Hai chấm ở giữa đại diện cho các ion Ca2+ và Mn2+
Sự khác nhau giữa các lectin thường thông qua quá trình oligo hóa (tạo cấu trúc bậc 4 từ các tiểu đơn vị bậc ba). Điều này thể hiện rất đặc trưng ở các lectin họ Đậu, có cấu trúc cá tiểu đơn vị bậc ba rất giống nhau nhưng cấu trúc bậc bốn hoàn toàn khác nhau.
Hầu hết các lectin là oligomer bao gồm hai đến bốn chuỗi polypeptide với mỗi chuỗi có một vị trí nhận diện carbohydrate. Một số có liên kết hóa trị với các gốc đường (glycoprotein lectin), nhưng một số không liên kết với gốc đường nào, ví dụ concanavalin A. Trọng lượng phân tử của oligomer chưa biến tính thay đổi từ 8,5 kDalt (cây tầm ma) đến 600 kDalt (Halocynthia roretzi). Một số lectin cần sự hiện diện của các ion hóa trị hai (Ca, Mn, Mg) để gắn với phối tử đường của chúng (ví dụ C-type lectin: Calcium Dependent lectin). Một số khác không cần các ion hóa trị hai mà cần sự hiện diện của các nhóm thiol, ví dụ lectin mầm lúa mạch. Tính đặc hiệu của một lectin được xác định bởi loại carbohydrate mà nó có ái lực cao nhất. Điều này có nghĩa là lectin cũng gắn với các gốc đường khác có cấu trúc tương tự nhưng với ái lực yếu hơn. Nói chung lectin tương tác với các nhóm glycosyl chưa khử của polysaccharide và glycoprotein, tuy nhiên một số có thể tương tác với các gốc đường nằm bên trong hoặc các gốc đường ở đầu khử của polysaccharide. Một số lectin có thể nhận diện từng loại đường đơn và điều này nói lên sự hiện diện của một vị trí gắn kết nhỏ. Ngược lại các lectin khác có xu hướng thiên về gắn kết với các trisaccharide hoặc tetrasaccharide và vì thế có vị trí gắn kết lớn. Người ta cho rằng các lectin gắn kết với các đường đa có tính đặc hiệu cao hơn đối với phối tử của chúng so với các lectin đặc hiệu đường đơn.
Phương thức tạo nên tính đặc hiệu với các gốc đường của lectin gồm: (1) tạo nên các cầu nước; (2) hiệu chỉnh hậu dịch mã và (3) oligomer hóa. Sự sắp xếp có trật tự của các phân tử nước liên kết với lectin tại vị trí gắn kết tạo nên tính đặc hiệu cho một số lectin họ Đậu đặc hiệu với các đường Gal/GalNAc. Jacalin là lectin đầu tiên được chứng minh là tính đặc hiệu phụ thuộc và quá trình hiệu chỉnh hậu dịch mã. Một ví dụ điển hình về quá trình oligomer hóa ảnh hưởng đến tính đặc hiệu là trường hợp của hoa tuyết điểm, hoa chuông lá tròn, thủy tiên hoa vàng và tỏi. Ba lectin đầu đều là tetramer còn lectin tỏi là dimer. Chúng đều có cấu trúc tiểu đơn vị như nhau, vị trí gắn đặc hiệu với Mannane như nhau và dimer hóa như nhau. Tuy nhiên ba loại lectin đầu có tính ái lực cao với glycoprotein HIV gp120 còn lectin tỏi không có tính chất này.
Ứng dụng[sửa]
Hai phát hiện lớn vào những năm 60 là động lực làm cho lectin trở thành trung tâm của sự chú ý. Phát hiện thứ nhất bởi Peter C. Nowell (1960) ở đại học Pennsylvania, Philadelphia, khi ông quan sát thấy lectin ở đậu cove hay PHA (Phaseolus vulgaris) có tính kích thích phân bào, tức nó có khả năng kích thích bạch cầu phân chia. Khám phá này có một tác động to lớn đến miễn dịch học vì nó phá vỡ quan niệm cho rằng lymphocyte là những tế bào biệt hóa tận cùng, không có khả năng phân chia hay biệt hóa nữa. Trong một khoảng thời gian ngắn, các lectin khác cũng được phát hiện thấy có tính kích thích phân bào. Một phát hiện có ý nghĩa trong số đó là concanavalin cũng có tính kích thích phân bào nhưng hoạt tính này bị ức chế bởi monosaccharide, ví dụ mannose ở nồng độ thấp. Phát hiện này cung cấp bằng chứng cho giả định rằng sự kích thích phân bào là kết quả của lectin gắn vào đường trên bề mặt bạch cầu và nó là một trong những bằng chứng đầu tiên về vai trò của phân tử đường bề mặt. Ngay lập tức các lectin kích thích phân bào được sử dụng làm công cụ nghiên cứu quá trình truyền tín hiệu vào tế bào và phân tích các sự kiện hóa sinh xảy ra trong quá trình kích thích bạch cầu trong điều kiện in vitro. Kết quả có giá trị nhất trong việc ứng dụng lectin vào các nghiên cứu này là khám phá của Robert C. Gallo & cs. vào thập kỷ 70 về nhân tố kích thích tăng sinh của tế bào T, hiện nay được biết dưới tên gọi interleukin-2 trong điều kiện nuôi cấy có sự kích thích của PHA.
Phát hiện thứ hai được khám phá bởi Joseph C. Aub ở bệnh viện đa khoa Massachusetts ở Boston. Ông phát hiện ra rằng agglutinin mầm lúa mạch (WGA) có khả năng ngưng kết thiên lệch đối với các tế bào ung thư. Tiếp sau đó là công bố của Max M. Burger ở đại học Princeton và Leo Sachs và Michael Inbar ở Weizmann Institute rằng concanavalin A cũng có biểu hiện tương tự. Cùng với Sachs và Ben-Ami Sela, Shannon và cs cũng phát hiện thấy agglutinin đậu tương cũng có tính chất này. Những nghiên cứu này cung cấp những bằng chứng đầu tiên về sự thay đổi các phân tử đường bề mặt tế bào liên quan đến sự hình thành ung thư và nó dẫn đến giả thuyết là các tế bào ung thư đều có chung tính chất bị gắn kết đặc hiệu với lectin. Tuy nhiên hiện nay giả thuyết này đã bị bác bỏ.
Một phát hiện quan trọng của nhóm nghiên cứu Sharon ở Viện khoa học Weizmann cho thấy bệnh lây nhiễm niệu đạo do E.Coli đặc hiệu đường mannose có thể bị ức chế bởi methyl α-D-mannoside. Đây là bằng chứng trực tiếp chứng tỏ sự tham gia của lectin vi khuẩn vào quá trình bắt đầu lây nhiễm & nó là cơ sở cho các nghiên cứu hiện nay sử dụng carbohyrate làm dược liệu chống kết dính tế bào trong công nghiệp Dược.
Nhóm Sharon cũng đã chứng minh được lectin vi khuẩn bề mặt đặc hiệu mannose chi phối sự gắn kết vi khuẩn vào đại thực bào khi không có quá trình opsonin hóa xảy ra, kết quả làm vi khuẩn bị đại thực bào nuốt và tiêu hủy. Điều này có ý nghĩa quan trọng trong việc tiêu diệt vi khuẩn ở những bộ phận nghèo opsonin như lõi thận hoặc khoang phúc mạc. Đây là một trong những bằng chứng về vai trò của lectin trong miễn dịch tự nhiên. Ngày nay người ta đã biết đến ba con đường kích hoạt bổ thể trong miễn dịch: con đường cổ điển, con đường thay thế và con đường lectin.
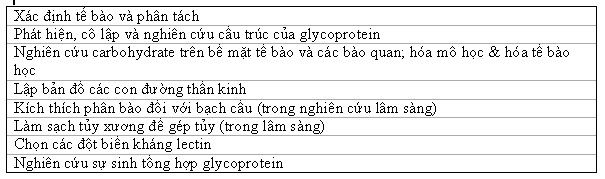
Lectin hiện nay chủ yếu được ứng dụng trong một số lĩnh vực sau:
Lectin kit đã được thương mại hóa để phục vụ cho mục đích nghiên cứu. Một ví dụ của nó là Lectin-Narcisssus-Pseudonarcissus Apoptosis-Necrosis-Detection Kit của công ty Biocat, Đức. Trong đời sống sự hiểu biết về lectin và sự tương tác đặc hiệu của nó với các gốc đường có thể giúp tránh những trường hợp ngộ độc thức ăn đáng tiếc ở một số người dị ứng với lectin. Ở động vật lectin cũng có thể gây ra ngộ độc thức ăn thông qua thực vật mà chúng tiêu thụ.
Vai trò sinh học của lectin[sửa]
Vai trò nổi bật nhất của lectin ở các sinh vật chính là chức năng nhận diện các gốc đường. Vai trò này thể hiện trong chức năng của lectin trong miễn dịch tự nhiên, trong quá trình homing của bạch cầu (selectins), trong quá trình loại bỏ các glycoprotein trong máu ở gan của động vật có xương sống (sialoglycoprotein). Có nhiều bằng chứng cho thấy lectin đóng vai trò như các chaperone trong việc điều phố sự vận chuyển glycorprotein nội bào, ví dụ Calnexin. Galectins được cho là một chất điều biến các tương tác tế bào có vai trò quan trọng trong sự biệt hóa và tăng sinh ở động vật đa bào. Chúng có khả năng kích thích tăng sinh hoặc apoptosis và được cho có quan hệ đến quá trình tạo thành các cơ quan, di căn ung thư, phản ứng miễn dịch...v.v.
Ở thực vật có hai giả thuyết về vai trò của lectin. Một giả thuyết cho rằng nó giúp bảo vệ thực vật chống lại vi khuẩn gây bệnh và con mồi. Giả thuyết thứ nhất dựa trên cơ sở quan sát ở Rehovot cho thấy lectin ức chế quá trình tạo bào tử nấm. Ngoài ra một quan sát khác ở bọ cánh cứng cho thấy nếu cho chúng ăn thức ăn có lectin đậu đen thì ấu trùng của chúng bị chết. Giả thuyết thứ hai dựa trên hiện tượng lectin của một giống đậu này thì chỉ đặc hiểu với loại vi khuẩn cộng sinh của riêng nó mà không đặc hiệu với các vi khuẩn của các giống đậu khác.
Lectin cũng đóng vai trò quan trọng đối với quá trình gắn virus vào tế bào vật chủ, mở đầu cho quá trình tấn công tế bào vật chủ của virus.
Nói chung lectin không có một chức năng đơn lẻ nào, và sự đa dạng của chúng không nhất thiết liên quan đến tầm quan trọng của vai trò của chúng. Một sinh vật có thể có nhiều hơn một lectin và chúng có thể không liên quan gì với nhau.
Có thể nhận thấy lectin không đóng nhiều vai trò trực tiếp quan trọng trong nghiên cứu cũng như trong y học nhưng vai trò gián tiếp của nó trong việc mở ra ngành nghiên cứu về Sinh học đường (glycobiology) cùng các hiện tượng nhận diện gốc đường bề mặt là vô cùng to lớn.
Tài liệu tham khảo[sửa]
- JL Carmalt, KP Rosel, T Burns and ED Janzen,Suspected white kidney bean (Phaseolus vulgaris)toxicity in horses and cattle Vet J Vol 81, No 11, November 2003
- Kurt Drickamer, Animal lectins classification, http://www.imperial.ac.uk/research/animallectins/ctld/lectins.html, 2006.
- Krispin Sullivan, The lectin report,[[1]]2000
- Nathan Sharon, Halina Lis, History of lectin: from hemagglutinin to biological recognition molecules, Glycobiology, vol. 14 no. 11 pp.53R-62R,2004
- Rafael Pont-Lezica, "Lectins", in AccessScience@McGraw-Hill, http://www.accessscience.com, DOI 10.1036/1097-8542.375600, last modified: April 10, 2000.
- Vijayan M.,Chandra Nagasuma, Lectins, Current Opinion in Structural Biology, 9:707-714, Elsevier Science Ltd., 1999