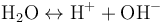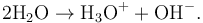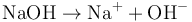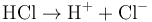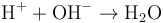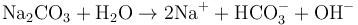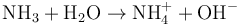Bazơ
 |
Bài
viết
hoặc
đoạn
này
cần
thêm
chú
thích
nguồn
gốc
để
có
thể
kiểm
chứng
thông
tin. Những nội dung không có nguồn có thể bị đặt vấn đề và xóa bỏ. Mời bạn bổ sung chú thích từ các nguồn đáng tin cậy để giúp cải thiện bài viết. |
Về các nghĩa khác của bazơ (base), xem thêm ở base (định hướng)
Bản mẫu:Axít và Bazơ Bazơ có công thức hoá học chung là B(OH)x.Một định nghĩa phổ biến của bazơ (còn được viết là base) theo Svante Arrhenius là một hợp chất hóa học hoặc là cung cấp các ion hiđrôxít hoặc là hấp thụ các ion hiđrô khi hòa tan trong nước. Các bazơ và các axít được nói đến như là các chất ngược nhau vì hiệu ứng của axít là tăng nồng độ ion hydroni (H3O+) trong nước, còn bazơ thì làm giảm nồng độ của ion này. Các bazơ theo Arrhenius là những chất hòa tan trong nước và có pH lớn hơn 7 khi ở trong dung dịch.Bazơ là hợp chất mà phân tử có một nguyên tử kim loại liên kết với một hay nhiều nhóm hidroxit (-OH)
Còn có nhiều định nghĩa khác về axít-bazơ có tính tổng quát hóa và tân tiến hơn.
Mục lục
Tính chất[sửa]
Những tính chất chung của các loại bazơ bao gồm:
- Có cảm giác nhờn, hoặc có mùi và có cảm giác như xà phòng khi cầm trên tay, vì sự xà phòng hoá của Lipid trong da người.
- Bazơ nồng độ cao và bazơ mạnh có tính ăn mòn chất hữu cơ và tác dụng mạnh với các hợp chất axit.
- Đổi màu các chất chỉ thị: dung dịch bazơ đổi màu quỳ tím thành màu xanh, dung dịch Phenolphthalein không màu thành màu hồng, giữ nguyên màu xanh của bromothymol, và đổi màu methyl cam thành màu vàng.
- Độ pH của dung dịch bazơ luôn lớn hơn 7.
- Bazơ có vị đắng.
- Có các Bazơ tan được trong nước: Na, Cs, K, Rb, Li, Fr: kiềm hóa trị 1 hoặc Be, Mg, Ca, Sr, Ba, Ra: kiềm thổ hóa trị 2. Tạo thành các dung dịch BaZơ là NaOH, Ca(OH)2, KOH, Ba(OH)2, LiOH, Mg(OH)2...
- Bazơ không tan: Fe(OH)2, Fe(OH)3, Cu(OH)2, Zn(OH)2, Al(OH)3...
- Bazơ tan có thể làm cho quỳ tím chuyển màu xanh - phenol phtalein chuyển màu đỏ.
Công thức [1][sửa]
- Nhóm hidroxit (-OH) có hóa trị I: -OH
- Công thức chung: M(OH)n.Trong đó, n là hóa trị của kim loại M.
Các bazơ thông dụng[sửa]
- Amoniac (NH3) và các amin.
- Pyridin và các bazơ vòng thơm khác.
- Các hiđrôxít kim loại như hiđrôxít natri (NaOH) hay hiđrôxít kali (KOH).
- Nhiều ôxít kim loại tạo ra hiđrôxít bazơ với nước (anhiđrít).
Phân loại bazơ theo tính tan[2][sửa]
Các bazơ được chia làm 2 loại tùy vào tính tan của chúng.[2]
- Bazơ tan được trong nước gọi là kiềm: LiOH, KOH, Ba(OH)2, Ca(OH)2, NaOH...
- Bazơ không tan: các hidroxit của nhiều kim loại (gồm Mg và các kim loại đứng sau Mg trong dãy hoạt động hóa học của kim loại): Al, Mn, Zn, Cr, Fe, Co, Ni, Sn, Pb, Cu,...
Tên gọi[2][sửa]
Bazơ được gọi tên theo trình tự:
Tên bazơ: tên kim loại (kèm hóa trị nếu kim loại có nhiều hóa trị)+hidroxit
Vd:NaOH:natri hidroxit
Ca(OH)2:canxi hidroxit
Cu(OH)2:đồng (II) hidroxit
Fe(OH)2:sắt (II) hidroxit
Bazơ và độ pH[sửa]
Độ pH của nước (không nguyên chất) được đo bởi độ axít của nó. Trong nước nguyên chất, khoảng 1/10 000 000 các phân tử phân ly thành các ion hiđrô (H+) hay hiđrôni (H3O+) và các ion hiđrôxít (OH−), tuân theo phương trình sau:
Chính xác hơn thì là:
Nồng độ (tính theo mol/lít) của các ion được biểu diễn như là [H+] và [OH−]; tích của chúng là hằng số điện li của nước và có giá trị 10−14 mol2l−2. Độ pH được định nghĩa như là −log [H+]; vì thế nước nguyên chất có pH bằng 7. (Các giá trị này đúng ở nhiệt độ 23 °C và sai khác một chút ở các nhiệt độ khác.)
Bazơ nhận (loại bỏ) các ion hiđrôni (H3O+) từ dung dịch, hoặc là cung cấp các ion hiđrôxít (OH−) cho dung dịch. Cả hai hoạt động này đều làm giảm nồng độ của các ion hiđrô, và vì thế làm tăng pH. Ngược lại, một axít cung cấp thêm các ion H+ cho dung dịch hay nhận các ion OH−, vì thế làm giảm pH.
Độ pH của dung dịch có thể tính toán được. Ví dụ, nếu 1 mol của hiđrôxít natri (40 g) được hòa tan trong 1 lít nước, nồng độ của các ion hiđrôxít là [OH−] = 1 mol/l. Vì vậy [H+] = 10−14 mol/l, và pH = −log 10−14 = 14.
Tính chất hóa học[3][sửa]
- Bazơ tan làm đổi màu chất chỉ thị (quỳ tím chuyển sang màu xanh, phenolphtalin không màu chuyển sang màu hồng.
- 1. Tác dụng của dung dịch bazơ với chất chỉ thị màu
Các dung dịch bazơ làm đổi màu chất chỉ thị: Quỳ tím thành màu xanh. Phenolphtalein không màu thành màu hồng.
2. Tác dụng của dung dịch bazơ với oxit axit
(dd) (r) (r) (l)
2NaOH + SO2 -> Na2SO3 + H2O
3Ca(OH)2 + P2O5 -> Ca3(PO4)2 + 3H2O
Dung dịch bazơ + oxit axit -> muối + nước
VD: (dd)+ (k)-> (dd) +(l)
3. Tác dụng của dung dịch bazơ với muối
dd bazơ + dd muối =muối mới + bazơ mới
Điều kiện: muối hoặc bazơ mới tạo thành phải không tan.
VD: 2NaOH + CuSO4 -> Cu(OH)2 + Na2SO4
(dd) (dd) (r) (dd)
Ba(OH)2 + Na2SO4 -> BaSO4 + 2NaOH
(dd) (dd) (r) (dd)
4. Tác dụng của bazơ với axit
Kiềm (bazơ tan) + axit muối + nước
VD:KOH + HCl -> KCl + H2O
(dd) (dd) (dd) (l)
Cu(OH)2 + 2HNO3 -> Cu(NO3)2 + 2H2O
(dd) (dd) (dd) (l)
Phản ứng giữa bazơ và axit được gọi là phản ứng trung hoà.
5. Bazơ không tan bị phân huỷ ở nhiệt độ cao
6.Bazơ không tan oxit bazơ + nước
VD:Cu(OH)2(r) CuO(r) + H2O(h)
-
Ví
dụ:
- Ca(OH)2 + CO2 → CaCO3 + H2O
- NaOH + CO2 → NaHCO3
- 2NaOH + CO2 → Na2CO3 + H2
- Phản ứng trao đổi với dung dịch muối (sản phẩm phải có kết tủa ↓)
-
- 3KOH + FeCl3 → 3KCl + Fe(OH)3 ↓
- Tác dụng với axit
-
Ví
dụ:
- NH3 + HCl → NH4Cl
- Zn(OH)2 + H2SO4 → ZnSO4 + H2O
- 3Ba(OH)2 + 2H3PO4 → Ba3(PO4)2 + 6H2O
- Ví dụ: Cu(OH)2 → CuO + H2O
Trung hòa axít[sửa]
Khi hòa tan trong nước, NaOH phân ly thành các ion hiđrôxít và natri:
tương tự, axít clohiđríc (HCl) tạo ra các ion hiđrôni và clorua:
Khi hai dung dịch này được trộn với nhau, các ion H+ và OH− tổ hợp với nhau tạo ra các phân tử nước:
Nếu các lượng bằng nhau của NaOH và HCl (đo theo mol, không phải tính theo gam) được hòa tan cùng nhau, bazơ và axít trung hòa nhau một cách chính xác, giải phóng ra NaCl (muối ăn) trong dung dịch.
Tính kiềm của các phi-hiđrôxít[sửa]
Cả cacbonat natri và amoniac đều là các bazơ, mặc dù không có chất nào chứa nhóm OH−. Có điều này bởi vì cả hai hợp chất đều nhận các ion H+ khi hòa tan trong nước:
và:
Xem thêm[sửa]
Tham khảo[sửa]
Liên kết ngoài[sửa]
 |
Bài
này
còn
sơ
khai. Mời bạn góp sức viết thêm để bài được hoàn thiện hơn. Xem phần trợ giúp về cách sửa bài. |
Liên kết đến đây
- Xem thêm liên kết đến trang này.