Review: Cấu trúc bậc 2 của protein
Thuật ngữ “cấu trúc bậc 2” chỉ dạng cấu trúc cục bộ của một số phần nào đó của chuỗi polypeptide. Thảo luận về cấu trúc bậc 2 chủ yếu tập trung vào dạng khung polypeptide. Một vài dạng cấu trúc bậc 2 xuất hiện nhiều trong protein. Nổi bật nhất là dạng xoắn (helix) và dạng đối xứng (conformation) được miêu tả ở dưới. Theo các nguyên tắc hóa học cơ bản và một vài quan sát thực nghiệm, Pauling và Corey dự đoán sự tồn tại của các dạng cấu trúc bậc 2 này vào năm 1951, một vài năm trước khi cấu trúc protein đầu tiên được làm sáng tỏ.
Dạng α-helix[sửa]
Sự phát triển của mô hình cấu trúc α-helix[sửa]
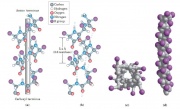
Mô hình chuỗi polypeptide xoắn của Pauling và Corey đưa ra nhiều cách để xác định từ bộ khung đến sự cân đối tuần hoàn trong cấu trúc đó, được phát hiện qua các dữ liệu nhiễu xạ của protein sợi α-keratin. Trật tự đơn giản nhất và ưa nhìn nhất là cấu trúc xoắn phải được gọi là α-helix.
Cách đơn giản để nhớ chuỗi xoắn phải khác chuỗi xoắn trái như thế nào là bằng cách nắm cả 2 bàn tay đặt phía trước bạn với ngón cái hướng lên trên và các ngón còn lại nắm vào. Mỗi ngón cái cho biết hướng dịch mã và các ngón kia nắm lại cho biết hướng xoắn.
Đặc tính của cấu trúc chuỗi α-helix[sửa]
Pauling và Corey đã biết tầm quan trọng của liên kết Hydrogen định hướng cho nhóm phân cực như CPO và NOH của liên kết peptide. Chúng đều là kết quả thí nghiệm của William Astbury, năm 1930 ông đã chỉ đạo nghiên cứu đầu tiên về tia X. Astbury đã chứng minh rằng protein cấu tạo lên tóc và lông (protein sợi α-keratin) có cấu trúc cân đối 5.15 đến 5.2 A0 (angstrom – 0.1 nm).
Cấu trúc này tự quay quanh nó mỗi vòng có chiều cao là 5.4 A0. Nên chúng ta nói rằng chuỗi xoắn α có chiều cao là 5.4 A0 tương ứng khoảng 3.6 amino acid mỗi vòng, ví dụ mỗi chuỗi xoắn có 36 amino acid thì gồm 10 vòng. Sự phân chia amino acid dọc theo trục xoắn là 5.4/3.6 hay độ cao (độ dày) là 1.5 A0Superscript text cho mỗi amino acid.
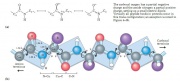
Cấu trúc này được bền vững hóa nhờ liên kết hydrogen gắn với nguyên tử nitrogen tích điện âm của liên kết peptide và nguyên tử carbonyl oxygen tích điện âm của amino acid thứ 4 trên vùng tận cùng của amino acid của liên kết peptide. Bên trong chuỗi helix, mỗi liên kết peptide (trừ liên kết kề với 2 đầu của chuỗi) tham gia vào liên kết peptide đó. Mỗi vòng liên tiếp của chuỗi helix chứa 3 đến 4 liên kết hydrogen. Tất cả liên kết hydrogen đó tạo nên tính ổn định cho cấu trúc chuỗi xoắn helix.
Một chuỗi helix cũng chứa amino acid dạng L hoặc D. Tuy nhiên tất cả các phần còn lại phải là đồng phân lập thể; một amino acid D sẽ gây trở ngại cho cấu trúc thường lệ chứa các amino acid L và ngược lại. Trong tự nhiên, amino acid L có thể tạo dạng xoẵn trái và phải, nhưng dạng xoắn trái không thấy xuất hiện ở protein sợi.
- Mỗi nhóm chính C=O và N-H sẽ tạo liên kết hydrogen với một liên kết peptide cách 4 amino acid (ví dụ, Oi với Ni+4). Điều này tạo một sự tuần hoàn, trật tự vững chắc.
- Bề mặt peptide khá song song với trục xoắn và sự lưỡng cực trong chuỗi có thứ tự, ví dụ tất cả nhóm C=O có cùng hướng và tất cả nhóm N-H xếp theo hướng khác. Các chuỗi bên hướng ra ngoài trục và thường hướng về phía amino acid cuối.
Tất cả các amino acid có góc phi và psi âm, tương ứng đặc trưng cho giá trị -60 độ và -50 độ
Trình tự amino acid ảnh hưởng đến tính bền vững của chuỗi α-helix[sửa]
Không phải tất cả polypeptide có thể tạo nên cấu trúc xoắn bền vững. sự tương tác giữa các chuỗi bên amino acid có thể làm bền hóa hoặc mất ổn định cấu trúc này. Ví dụ, nếu một chuỗi polypeptide có một đoạn dài mang Glu, đoạn này sẽ không hình thành dạng xoắn ở pH=7. Nhóm carboxyl tích điện âm gần kề với Glu còn lại sẽ đẩy nhau mạnh ngăn cản sự hình thành chuỗi xoắn. Vì một nguyên nhân tương tự, nếu có nhiều Lys và/hoặc Arg mang nhóm R tích điện dương ở pH=7, chúng sẽ đẩy nhau và ngăn cản sự hình thành cấu trúc xoắn. Các amino acid khác như Asn, Ser, Thr và Cys có thể làm mất sự ổn định của chuỗi xoắn nếu chúng gần nhau trong chuỗi.
Sự xoắn cuộn của chuỗi xoắn xảy ra giữa một chuỗi amino acid và phần dư 3 chuỗi (đôi khi là 4) nằm cách xa vùng kia. Amino acid tích điện dương thường thấy cách 3 amino acid so với tích điện âm, cho phép sự hình thành một cặp ion. 2 amino acid thơm thường nằm ở vị trí giống nhau hình thành tương tác kỵ nước, và một số amino acid ức chế sự hình thành dạng xoắn alpha là Pro và Gly.
Trong Proline, nguyên tử nitrogen là một phần của một vòng vững chắc nên liên kết NOC không thể quay được. Vì thế, Pro không ủng hộ việc hình thành dạng xoắn, hơn nữa nitrogen của Pro trong liên kết peptide không có hydrogen thay thế tham gia vào liên kết hydrogen với amino acid khác. Vì những kí do này, proline hiếm khi thấy trong cấu trúc xoắn.
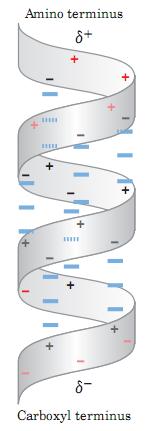
Yếu tố cuối cùng ảnh hưởng đến sự bền vững của chuỗi xoắn là sự đồng nhất của các amino acid nằm gần điểm cuối của mỗi đoạng xoắn. Mỗi liên kết peptide tồn tại 2 cực điện. Các cực này liên kết với nhau thông qua liên kết hydrogen của chuỗi xoắn, dẫn đến mạng lưới lưỡng cực dọc theo chiều dài của chuỗi. 4 amino acid nằm cuối cùng của chuỗi không tham gia vào liên kết hydrogen. Cực âm và cực dương của vùng lưỡng cực chính tại nhóm amino và carbonyl gần đầu tận cùng amino và carbonyl tương ứng. Vì thế, các amino acid thường thấy ở đầu tận cùng amino của đoạn xoắn, nơi có tương tác bền với cực dương của đoạn xoắn lưỡng cực; amino acid tích điện dương ở đầu tận cùng amino ít bền vững. Điều ngược lại xảy ra ở đầu tận cùng của đoạn xoắn.
Có 5 mối liên hệ khác ảnh hưởng đến sự bền vững của chuỗi xoắn: 1) lực đẩy tĩnh điện (lực hấp dẫn) giữa các amino acid liền kề với nhóm R tích điện, 2) cấu hình của nhóm R kề bên, 3) sự tương tác giữa nhóm R của 3 hoặc 4 amino acid riêng biệt, 4) sự hiện diện của Pro và Gly, 5) sự tương tác giữa amino acid ở cuỗi đoạn xoắn và điểm lưỡng cực vốn có của chuỗi xoắn. Kiểu cấu thành chuỗi xoắn trên phụ thuộc vào sự đồng nhất và trình tự của amino acid bên trong đoạn xoắn.
Sự co méo của dạng α-helix[sửa]
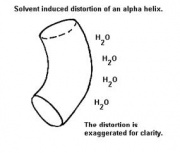
Đa số các vòng xoắn trong protein cầu bị cong và méo một chút so với mô hình chuẩn của Pauling và Corey. Sự cong méo này do một số yếu tố sau:
- Việc đóng gói các vòng xoắc ốc bị vùi ngăn cản các yếu tố cấu trúc bậc 2 trong lõi protein.
- Proline gây ra sự cong méo khoảng 20 độ so với trục, bởi vì proline không thể tạo nên chuỗi xoằn α tuần hoàn do sự cản trở của cấu trúc không gian có tính chu kỳ của chuỗi đã ngăn nguyên tử N và ngăn cản nó hình thành liên kết hydrogen. Janet Thomas đã chỉ ra rằng proline làm cho 2 liên kết hydrogen trong chuỗi xoắn bị phá vỡ khi nhóm NH của amino acid kế tiếp cũng bị ngăn không cho hình thành liên kết hydrogen. Vòng xoắn chứa proline thường dài bởi vòng xoắn ngắn chứa proline thường bị làm mất ổn định bởi sự xuất hiện của proline. Proline thường tác động nhiều trong vùng mở rộng của chuỗi polypeptide.
- Khả năng hòa tan. Vòng xoắn bị lộ thường có xu hướng tránh xa vùng hòa tan. Do nhóm C=O lộ ra ngoài có xu hướng dễ hòa tan để gia tăng năng lực của liên kết hydrogen, ví dụ xu hướng tạo liên kết H để hòa tan cũng như tạo nhóm NH. Điều này làm gia tăng sự uốn của trục xoắn.
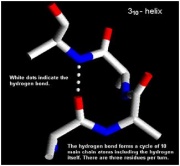
Dạng xoắn 310[sửa]
Dạng này rất hiếm, cấu trúc này là một dạng xoắn khác biệt nhưng chúng thường ngắn và xuất hiện ở vùng cuối của chuỗi xoắn α thường. Tên 310 nghĩa là có 3 aminoacid ở mỗi vòng và 10 nguyên tử vây quanh nhau thành một vòng kín tạo bởi liên kết H (chú ý là nguyên tử H cũng tham gia vào nhóm này). 3 liên kết của chuỗi chính nằm giữa các amino acid bị chia cắt bởi 3 amino acid nằm dọc chuỗi (ví dụ, Oi đến Ni+3). Theo danh pháp này thì mô hình của Pauling và Corey là chuỗi xoắn 3.613, lưỡng cực của chuỗi xoắn 310 không có trật tự như dạng chuỗi xoắn α, ví dụ nó là cấu trúc ít bền vững hơn và là chuỗi có ít sự liên hợp.
Dạng β-sheet[sửa]
Cấu trúc khái quát[sửa]
Pauling và Corey đưa ra mô hình về cấu trúc đối xứng của protein sợi β-keratin. Trong dạng cấu trúc polypeptide này không có dạng xoắn ốc. thay vì thế, nó có dạng zigzag hơn là xoắn α. Amino acid trong cấu trúc đối xứng β các góc Φ và Ψ có giá trị dương. Giá trị đặc trưng của Φ là -140 độ và Ψ là 130 độ. Ngược lại, amino acid của xoắn thì cả 2 góc này mang giá trị âm. Một vùng của polypeptide mà các amino acid tồn tại dạng đối xứng sẽ là dạng sợi β và các sợi này liên kết với nhau thông qua liên kết H để tạo thành phiến.
Trong một phiến beta với 2 hoặc nhiều hơn 2 chuỗi polypeptide chạy dọc nhau và được liên kết theo một phương thức chung bởi liên kết hydrogen giữa các nhóm CO và NH của chuỗi chính. Vì vậy tất cả các liên kết hydrogen trong phiến alpha là tạo bởi các đoạn khác nhau trong chuỗi polypeptide. Sự đối ngược này với dạng xoắn alpha nơi mà tất cả liên kết hydrogen gồm yếu tố giống ở cấu trúc bậc 2. Nhóm R (các chuỗi bên) của các amino acid “láng giềng” trong điểm chuỗi beta ngược hướng.
Cấu trúc đối xứng làm các chuỗi polypeptide hình thành dạng phiến (sheet)[sửa]
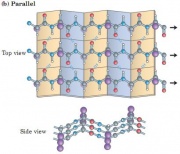
Cấu trúc protein-phiến: Pauling và Corey dự đoán một cấu trúc lặp lại bậc 2, trật tự phân tử lặp-conformation. Trong dạng đối xứng (conformation), bộ khung của chuỗi polypeptide được mở rộng thành dạng zigzag hơn là dạng xoắn. Các chuỗi polypeptide zigzag có thể được sắp xếp kế tiếp nhau tạo thành cấu trúc một loạt các nếp gấp-gọi là phiến (sheet); liên kết hydrogen được tạo bởi các đoạn kề nhau của chuỗi polypeptide. Các chuỗi polypeptide trong một phiến có thể song song hoặc đối song (cùng hoặc ngược hướng amino – carboxyl tương ứng). Cấu trúc này khá giống nhau, mặc dù đoạn lặp lại ở cấu trúc song song là ngắn hơn (6.5 A0, ở cấu trúc đối song là 7A0) và kiểu liên kết hydrogen khác nhau.
Một vài cấu trúc prptein giới hạn nhiều loại amino acid xuất hiện trong sheet. Khi hai sheet hoặc nhiều hơn được bao phủ gần nhau trong protein, nhóm R của các amino acid trên bề mặt phải tương đối nhỏ. Keratin-fibroin lụa và fibroin ở mạng nhện chứa nhiều Gly và Ala, 2 amino acid này có nhóm R nhỏ nhất. Quả thật, trong fibroin lụa Gly và Ala đan xen các phần lớn của trình tự.
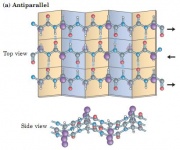
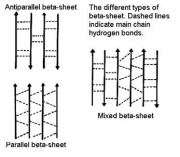
Phiến beta song song (parallel), đối song (anti-paraellel) và hỗn hợp (mixed)[sửa]
Trong phiến beta song song, tất cả các sợi chạy cùng một hướng, trong khi đó trong các phiến đối song, chúng chạy ngược hướng nhau. Trong phiến hỗn hợp, một vài sợi song song và một số khác đối song nhau.
Trong mô hình cổ điển của Pauling và Corey, phiến beta song song ít có sự uốn xoắn nên liên kết hydrogen giữa các sợi yếu hơn.
Các phiến beta rất phổ biến trong các protein hình cầu, và hầu hết gồm ít hơn 6 chuỗi. Độ rộng của phiến beta 6 chuỗi khoảng 25 A0. Không có kết quả nào ở dạng song song và đối song được quan sát thấy, nhưng phiến song song có ít hơn 4 chuỗi là rất hiếm, có thể điều này ảnh hưởng đến sự bền vững của chúng. Phiến này có xu hướng một là tất cả song song nhau hoặc tất cả đối song nhau, còn dạng hỗn hợp không xuất hiện.
Phiến beta song song ít xoắn hơn dạng đối song và luôn bị chôn vùi. Ngược lại, phiến đối song có thể thấy sự xoắn rõ rệt hơn (twisting và beta-bulbe) và dễ hòa tan hơn. Điều này có nghĩa là phiến đối song bền vững hơn dạng song song cái mà luôn có định hình ổn định liên kết hydrogen và thực tế là ít khi thấy dạng phiến song song.
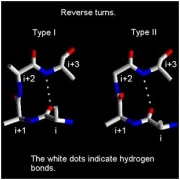
Vòng ngược (reverse turns)[sửa]
Một vòng ngược là vùng của chuỗi polypeptide có liên kết hydrogen tử một nhóm CO ở chuỗi chính với nhóm NH cũng ở chuỗi chính trong 3 amino acid (ví dụ Oi đến Ni+3). Vùng xoắn bị loại khỏi định nghĩa này và vòng giữa sợi beta tạo một lớp đặc biệt được gọi là vòng kẹp tóc beta (beta-hairspin). Vòng ngược rất phổ biến trong protein hình cầu và thường thấy ở bề mặt của phân tử. người ta cho rằng các vùng này hoạt động như là trung tâm hoạt động trong quá trình gấp cuộn protein.
Vòng ngược được chia thành các lớp dựa trên góc phi ( và psi ( của amino acid ở vị trí i+1 và i+2. Loại I và loại II nếu trong hình dưới là dạng vòng phổ biến nhất, sự khác nhau chính giữa chúng là sự tồn tại hướng của liên kết peptide giữa các amino acid ở (i+1) và (i+2).
Góc xoắn giữa amino acid (i+1) và (i+2) trong 2 loại nằm trong các vùng khác nhau của đồ thị Ramachadran.
Chú ý rằng phần (i+2) của loại II nằm trong một vùng đồ thị Ramachandran có thể chỉ thấy ở Glycine. Từ sơ đồ của vòng này, nó có thể thấy được đó là phần (i+2) có một chuỗi bên. Vì thế, phần (i+2) trong vòng ngược loại 2 gần như luôn là glycine.