Đột phá mới nhất trong điều trị ung thư: Tế bào CAR-T
Ngày 12/07/2017, Cục Quản Lý Thực Phẩm và Thuốc của Hoa Kỳ (US Food and Drug Administration, viết tắt FDA) vừa thống nhất thông qua với 10/10 phiếu bầu một liệu pháp điều trị ung thư mang tính đột phá, đặc biệt ung thư giai đoạn “không còn cách cứu chữa”. Đó là tế bào CAR-T đầu tiên trên thế giới có tên Tisagenlecleucel (CTL019) của hãng dược Novartis.
Mục lục
- 1 I. Tế bào CAR-T là gì?
- 2 II. Cơ chế hoạt động của CAR-T [1] [2]
- 3 III. Quá trình sản xuất và sử dụng tế bào CAR-T trong điều trị ung thư [1]
- 4 IV. Kết quả thử nghiệm lâm sàng
- 5 V. Một số tác ụng phụ của liệu pháp miễn dịch tế bào CAR-T [3]
- 6 VI. Thử thách và hi vọng cho tương lai
- 7 Tài liệu tham khảo
- 8 Tác giả
- 9 Nguồn
I. Tế bào CAR-T là gì?[sửa]
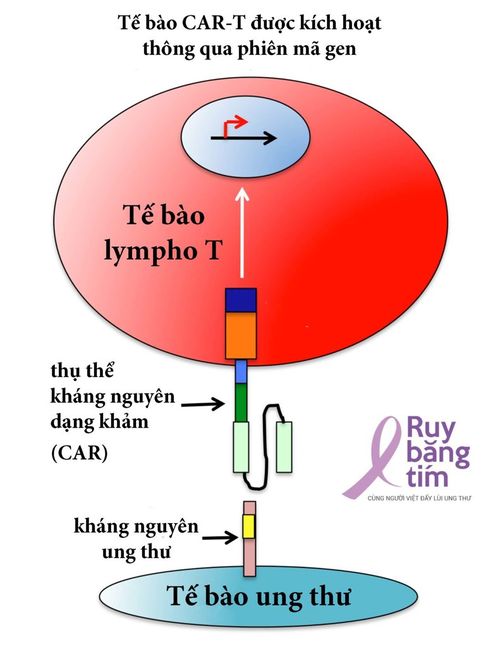
CAR-T được viết tắt từ Chimeric Antigen Receptor T-cell, dịch là tế bào lympho T chứa thụ thể kháng nguyên dạng khảm[1]. Thụ thể là một phân tử protein nằm trên màng hay trong tế bào nhận tín hiệu hoá học từ bên ngoài vào trong tế bào, tương tự vai trò “cánh tay” hay “đôi mắt” của tế bào lympho T. Trong trường hợp CAR-T, thụ thể nối dài từ ngoài vào trong như hình. Kháng nguyên là một phân tử kích thích đáp ứng miễn dịch của cơ thể. Dạng khảm là dạng được lai từ ít nhất 2 cá thể khác nhau.
CAR-T thuộc nhóm liệu pháp miễn dịch. Liệu pháp miễn dịch được giới nghiên cứu khoa học gọi là “cột trụ thứ 5” trong điều trị ung thư bên cạnh 4 phương pháp khác: phẫu thuật, hoá trị, xạ trị, liệu pháp nhắm trúng đích[2].
II. Cơ chế hoạt động của CAR-T [1] [2][sửa]
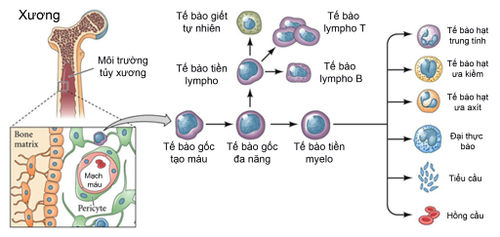
Hệ miễn dịch tự nhiên của cơ thể là một hàng rào chắn chống lại bệnh lây nhiễm và bệnh ung thư. Hệ miễn dịch được xây dựng từ hàng tỉ tế bào được chia thành nhiều loại khác nhau như hình minh hoạ sau.
Nhóm tế bào lympho lại được chia thành những nhóm sau:
- Tế bào lympho B sản xuất kháng thể chống lại bệnh truyền nhiễm.
- Tế bào lympho T và tế bào giết tự nhiên trực tiếp tấn công những tế bào bị nhiễm hoặc có dấu hiệu ung thư, đồng thời liên lạc với những tế bào khác trong hệ miễn dịch bằng cytokine (chất trung gian điều hoà hoạt động giữa các tế bào trong cơ thể).
Liệu pháp miễn dịch (bao gồm CAR-T) dựa vào hệ miễn dịch để chống lại ung thư bằng cách nâng cao khả năng phát hiện và diệt trừ tế bào ung thư của những tế bào hệ miễn dịch. Nói một cách nôm na, tế bào ung thư như những kẻ tội phạm và tế bào lympho T như cảnh sát chuyên đi bắt và xử lý tội phạm. Song vì tội phạm “ung thư” quá giỏi trong việc giả dạng người lành (tế bào bình thường) nên cảnh sát thường bỏ sót, tạo cơ hội cho chúng sinh sôi nảy nở (khối u ác tính di căn). Phương pháp CAR-T như một trường cảnh sát huấn luyện và trang bị công cụ đặc biệt (CAR) để cảnh sát nhận biết và xử lý kẻ xấu dễ dàng và chính xác hơn. Khi vào cơ thể, CAR-T sẽ đi tuần tra khắp nơi và chạm công cụ đặc biệt CAR vào đối tượng để xác định đây là tội phạm để xử lý hay người bình thường.
III. Quá trình sản xuất và sử dụng tế bào CAR-T trong điều trị ung thư [1][sửa]
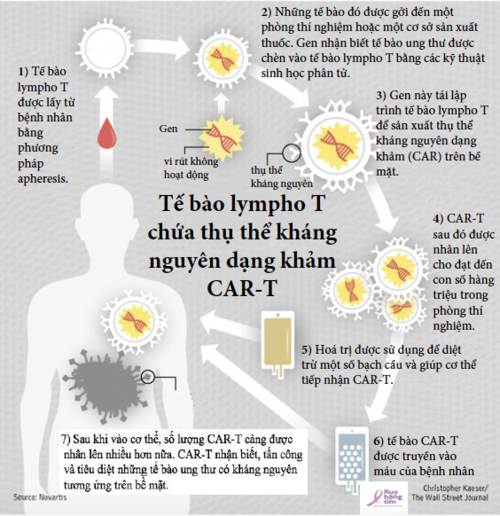
1) Tế bào lympho T được lấy từ bệnh nhân bằng phương pháp apheresis (máu được truyền từ bệnh nhân qua một thiết bị phân tách chỉ để tách riêng 1 thành phần nhất định và những thành phần khác được truyền lại vào bệnh nhân).
2) Những tế bào đó được gởi đến một phòng thí nghiệm hoặc một cơ sở sản xuất thuốc. Gen nhận biết tế bào ung thư được chèn vào tế bào lympho T bằng các kỹ thuật sinh học phân tử.
3) Gen này tái lập trình tế bào lympho T để sản xuất thụ thể kháng nguyên dạng khảm (CAR) trên bề mặt. Từ đó, những tế bào này có tên là tế bào lympho T chứa thụ thể kháng nguyên dạng khảm, hay CAR-T.
4) CAR-T sau đó được nhân lên cho đạt đến con số hàng triệu trong phòng thí nghiệm, rồi được đông lạnh và gởi trả lại cho bệnh viện hay cơ sở điều trị của bệnh nhân.
5) Hoá trị được sử dụng để diệt trừ một số bạch cầu và giúp cơ thể tiếp nhận CAR-T.
6) Tại bệnh viện hay cơ quan điều trị, tế bào CAR-T được truyền vào máu của bệnh nhân.
7) Sau khi vào cơ thể, số lượng CAR-T càng được nhân lên nhiều hơn nữa. Những tế bào này đã được lập trình để nhận biết, tấn công và tiêu diệt những tế bào ung thư có kháng nguyên tương ứng trên bề mặt. Tế bào CAR-T có thể tồn tại trong cơ thể một thời gian dài sau thời điểm được truyền vào máu, nên chúng có thể bảo vệ cơ thể khỏi tái phát ung thư. Vì vậy mà phương pháp này có thể điều trị khỏi ung thư trong thời gian dài.
IV. Kết quả thử nghiệm lâm sàng[sửa]
- Một nghiên cứu được tài trợ bởi Novartis đang diễn ra ở 25 trung tâm y tế ở Mỹ, Canada, Châu Âu, Nhật và Úc quy tụ 63 bệnh nhân từ 3 đến 21 tuổi mắc phải bệnh ung thư bạch cầu lympho B cấp tính (một loại ung thư máu và xương phát triển nhanh và đột ngột) bị tái phát hoặc khó chữa. 82.5% (52/63 bệnh nhân) đã hoàn toàn khỏi bệnh trong vòng 3 tháng sau khi được truyền Tisagenlecleucel (CTL019)[3]. Nghiên cứu này đã giúp Tisagenlecleucel (CTL019) trở thành tế bào CAR-T đầu tiên được thông qua bởi FDA.
- Một nghiên cứu tại trường đại học Pennsylvania tại Mỹ đã và đang thử nghiệm Tisagenlecleucel (CTL019) trên 30 bệnh nhân từ 1 đến 24 tuổi khi họ bị tái phát bệnh ung thư bạch lympho cấp tính sau khi đã trải qua một hay nhiều đợt điều trị bằng những phương pháp khác. 90% (27/30 bệnh nhân) đã hoàn toàn khỏi bệnh [4]. Tỷ lệ hoàn toàn khỏi bệnh trên 6 tháng là 67%. CAR-T sau khi được truyền vào cơ thể đã lan rộng từ máu, tuỷ xương cho đến dịch não.
- Nghiên cứu khác tại trường đại học Washington/Bệnh viện nhi Seattle/Trung tâm nghiên cứu ung thư Fred Hutchinson tại Mỹ mở rộng lứa tuổi từ 1 đến 75 tuổi với các loại bệnh ung thư bạch cầu đã chữa lành ung thư hoàn toàn cho 85% (11/13 bệnh nhân) và nghiên cứu này vẫn đang tiếp diễn[5]. Phương pháp CAR-T được sử dụng trong nghiên cứu này là JCAR015 của công ty dược Juno, vẫn chưa được thông qua bởi FDA.
Hiện tại có khoảng gần 200 nghiên cứu và thử nghiệm với CAR-T đang diễn ra ở Mỹ và 201 nước khác trên thế giới được ghi nhận bởi https://clinicaltrials.gov/ của chính phủ Mỹ[6]. Một số bệnh ung thư khác đang được thử nghiệm với CAR-T:
- Sarcoma (ung thư phát sinh từ xương, mô liên kết như mỡ và cơ)[7]
- Nguyên bào thần kinh đệm (ung thư phát sinh từ những tế bào hình ngôi sao tạo nên mô đệm cho não bộ, tiếng anh glioblastoma) có thụ thể yếu tố tăng trưởng biểu bì ở người (human epidermal growth factor receptor 2, viết tắt HER2)[8]
- Nguyên bào thần kinh (ung thư phát sinh từ tế bào thần kinh sơ niên của hệ thống thần kinh giao cảm, tiếng anh neuroblastoma)[9]
V. Một số tác ụng phụ của liệu pháp miễn dịch tế bào CAR-T [3][sửa]
- Khoảng 78% bệnh nhân được thử nghiệm CAR-T mắc phải hội chứng phóng thích cytokine (cytokine release syndrome, viết tắt CRS). Như đã nói trong phần II cơ chế thì sự kích hoạt tế bào lympho T gây ra CRS, nên CRS cũng chính là dấu hiệu CAR-T đã hoạt động tích cực xử lý những tế bào ung thư. Tuy nhiên, quá nhiều cytokine (mức 3 hoặc 4/4) cũng có thể gây nguy hiểm đến tính mạng của bệnh nhân. Những triệu chứng khác đi kèm với CRS: sốt, huyết áp thấp, phổi hấp thụ oxy kém (nên yêu cầu những phương pháp bổ sung oxy tạm thời), mê sảng, hỗn loạn, và co giật [1]. Vì vậy bệnh nhân chữa ung thư theo phương pháp CAR-T thường được nhập viện và quan sát chặt chẽ.
- 40% sốt
- 37% sốt giảm bạch cầu (febrile neutropenia)
- 37% biếng ăn
- 35% đau đầu
- 31% huyết áp thấp
- 31% thiếu máu
Một số tác dụng phụ khác từ 30% trở xuống: giảm gamma globulin, giảm bạch cầu và tiểu cầu, nôn mửa, tiêu chảy, mệt mỏi…
VI. Thử thách và hi vọng cho tương lai[sửa]
Tuy mang lại hi vọng cho những bệnh nhân ung thư hiểm nghèo không thể chữa bằng trị liệu thông thường, CAR-T trong vẫn còn nhiều khiếm khuyết cần khắc phục để thực sự trở thành một trụ cột thứ 5 trong điều trị ung thư. Đầu tiên là giá thành cho một đợt chữa trị duy nhất có thể lên đến gần 7 tỷ đồng (300.000 đô la Mỹ)[10]. Giá thành này có thể hiểu được bởi CAR-T vẫn còn trong giai đoạn đầu nghiên cứu và số lượng sản xuất hiếm hoi, hiện chỉ có công ty dược Norvatis với sản phẩm Tisagenlecleucel được thông qua bởi FDA. Norvatis cũng được chính phủ Mỹ trao độc quyền sản xuất Tisagenlecleucel trong vòng 20 năm, ngăn chặn những hãng dược khác sản xuất cùng loại. Giá thành cao cũng vì việc sản xuất CAR-T cũng phải được cá nhân hoá cho từng bệnh nhân chứ không sản xuất/áp dụng hàng loạt như những phương pháp khác và quá trình sản xuất CAR-T vẫn còn khá chậm. Bên cạnh đó, vẫn có một số trường hợp bệnh nhân tử vong vì tác dụng phụ của CAR-T, nên CAR-T cần được nghiên cứu thêm và điều chỉnh để đảm bảo sự an toàn của bệnh nhân hoặc thiết kế một phác đồ điều trị rõ ràng để giảm tỷ lệ tử vong do thuốc.
Theo Tiến sĩ, Dược sĩ Nguyễn Đức Thái, cố vấn khoa học – hợp tác quốc tế, Đại Học Y Dược TPHCM, trong trường hợp của Việt Nam, vì điều kiện kinh tế, kiến thức và kinh nghiệm về CAR-T còn giới hạn, CAR-T vẫn chưa thể áp dụng để điều trị ung thư ở Việt Nam như ở Mỹ[11]. Tuy còn rất nhiều thử thách, Việt Nam vẫn tiếp tục kết hợp với hững nước khác như Nhật Bản và Singapore để triển khai kế hoạch nghiên cứu và thử nghiệm lâm sàng ở nước nhà.
Lưu ý: Bài viết này chỉ có mục đích tham khảo, hoàn toàn không nhằm mục đích chữa trị bất cứ bệnh tật nào. Xin vui lòng trao đổi trực tiếp với bác sĩ hay điều trị viên có kiến thức và hiểu rõ về bệnh tình của bạn để được tư vấn thêm.
Tài liệu tham khảo[sửa]
- ↑ 1,0 1,1 1,2 1,3 “Chimeric Antigen Receptor (CAR) T-cell therapy.” Leukemia and lymphoma society. Web, July 22, 2017. <https://www.lls.org/treatment/types-of-treatment/immunotherapy/chimeric-antigen-receptor-car-t-cell-therapy>
- ↑ 2,0 2,1 “CAR T-cell therapy: engineering patients’ immune cells to treat their cancers.” NIH National Cancer Institute (2014). Web, July 22, 2017. <https://www.cancer.gov/about-cancer/treatment/research/car-t-cells>
- ↑ 3,0 3,1 “BLA 125646 Tisagenlecleucel Novartis Pharmaceuticals Corporation.” U.S. Food and Drug Administration. Web, July 22, 2017. <https://www.fda.gov/downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/OncologicDrugsAdvisoryCommittee/UCM566166.pdf>
- ↑ Maude SL, Frey N, Shaw PA, Aplenc R, Barrett DM, Bunin NJ, Chew A, Gonzalez VE, Zheng Z, Lacey SF, Mahnke YD, Melenhorst JJ, Rheingold SR, Shen A, Teachey DT, Levine BL, June CH, Porter DL, Grupp SA. “Chimeric antigen receptor T cells for sustained remissions in leukemia.” N Engl J Med 371.16 (2014). Web, July 22, 2017. <https://www.ncbi.nlm.nih.gov/pubmed/25317870>
- ↑ Tasian S, Gardner R. “CD19-redirected chimeric antigen receptor-modified T cells: a promising immunotherapy for children and adults with B-cell acute lymphoblastic leukemia.” Ther Adv Hematol 6.5 (2016). Web, July 22, 2017. <https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4556967/>
- ↑ Clinical trials.gov A service of the U.S. National Institutes of Health. Web, July 22, 2017. <https://clinicaltrials.gov/ct2/results?cond=&term=car-t&cntry1=&state1=&recrs=a>
- ↑ Her2 chimeric antigen receptor expressing T cells in advanced sarcoma. Web July 29, 2017. <https://clinicaltrials.gov/ct2/show/NCT00902044>
- ↑ CMV-specific cytotoxic T lymphocytes expressing CAR targeting HER2 in patients with GBM (HERT-GBM). Web July 29, 2017. <https://clinicaltrials.gov/ct2/show/NCT01109095>
- ↑ Blood T-cells and EBV specific CTLs expressing GD-2 specific chimeric T cell receptors to neuroblastoma patients (NESTLES). Web July 29, 2017. <https://clinicaltrials.gov/ct2/show/NCT00085930>
- ↑ Ramsey L. “There’s a race to get 2 revolutionary new cancer treatments on the market – here’s who’s in the lead.” Business Insider (2017). Web, July 22, 2017. <http://www.businessinsider.com/car-t-cell-therapy-cancer-treatment-face-off-2017-6>
- ↑ Nguyen TD. “Tế bào T trị liệu ung thư: TCR-engineered T và CAR-T.” Facebook (2017). Web, July 22, 2017. <https://www.facebook.com/petertigr/posts/830288120444457?pnref=story>
Tác giả[sửa]
- Chịu trách nhiệm nội dung: Tee Nguyễn
- Góp ý nội dung: TS. Nguyễn Hồng Vũ, ThS Trịnh Vạn Ngữ