Giải Nobel Y học 2006
Giải Nobel trong sinh lý học hay y học năm nay được trao cho Giáo sư Andrew Z.Fire, Đại học Stanford, California, Mỹ và Giáo sư Craig.C.Mello, Đại học y Massachusetts, Worcester, Mỹ. Họ nhận giải nobel cho công khám phá ra RNA mạch kép gây nên sự tăng cường hoạt động gene trong một kiểu tương đồng phụ thuộc, một quá trình có tên là can thiệp RNA (RNAi). Khám phá của họ đã phát giác một cơ chế mới điều hòa gene, và cơ chế hóa sinh học liên quan giữ vai trò then chốt trong nhiều quá trình ngoại bào thiết yếu. Tổng hợp RNA mạch kép bên trong tế bào có thể giảm bớt hoặc thủ tiêu hoạt động gene bằng can thiệp RNA - như cơ chế. Hệ thống kiểm soát biểu hiện gene này đã chứng tỏ tầm quan trọng cho cả sự phát triển của một tổ chức lẫn chức năng sinh lý học của tế bào và mô. Hơn nữa, can thiệp RNA bảo vệ chống lại sự nhiễm virus RNA, đặc biệt ở thực vật và động vật có xương sống và bảo đảm ổn định hệ gene bằng cách giữ im lặng các nhân tố di động. Hiện nay, mạch kép RNA được sử dụng như một công cụ mạnh mẽ để thử nghiệm giải thích chức năng của bất kì gene thiết yếu nào trong tế bào. Sự khám phá ra can thiệp RNA vừa có một ảnh hưởng to lớn trong nghiên cứu y sinh học và hầu như sẽ lãnh đạo thuyết ứng dụng y học trong tương lai.
Mục lục
Giới thiệu[sửa]
Quá trình biểu hiện gene là một nguyên tắc cơ bản quan trọng đối với mọi cơ thể sống. Hầu hết gene cư trú trên nhiễm sắc thể định vị trong nhân tế bào và tự biểu hiện thông qua hệ thống tổng hợp protein trong tế bào chất. Nguyên liệu di truyền đã được xác định như deoxyribonucleic acid (DNA) vào 1944 1 và dạng xoắn kép tự nhiên của DNA được phát giác vào 1953 (bởi Francis Cricks, Jame Watson và Maurice Wilkins - giải Nobel sinh lý học hay y học 1962). Cùng thời điểm, vấn đề chính nổi lên là bằng cách nào DNA trong nhân tế bào có thể chi phối tổng hợp protein trong tế bào chất. Điều đó đề xuất một nucleic acid khác (RNA), hoạt động như chất trung gian trong quá trình. Và vì thế thuyết trung tâm đã được phát biểu có hệ thống,ví dụ thuyết cho rằng thông tin di truyền được phiên mã từ DNA sang RNA và sau đó dịch mã từ RNA thành protein. RNA mang thông tin di truyền đầu tiên người ta tin là RNA trong ribosome. Do đó trong nhiều năm thuyết trên được phát biểu có hệ thống là "một gene - một ribosome - một protein ". Vào 1961, Francois Jacob và Jacques Monod đã miêu tả một phương thức điều hòa gene tưởng tượng, họ nhận giải Nobel trong sinh lý học hay y học 1965 cùng với Andre Lwoff. Trong phương thức của họ, họ đề xuất rằng gene được phiên mã thành một loại RNA chuyên biệt, RNA thông tin (mRNA). Sau này,mRNA được chứng minh có đời sống ngắn, không phải RNA ribosome chỉ đạo sản tổng hợp protein. Rồi thì, Marshall Nirenberg và Gobind Khorana đã làm gián đoạn mã di truyền và đã có thể ấn định từ mã hóa (codon,bộ ba nucleotide) thành hai mươi amino acid (họ nhận giải Nobel sinh lý học hay y học 1968 cùng với Robert Holley). Francis Cricks đã dự đoán rằng một phân tử RNA có thể hoạt động như một chất nhận giữa mRNA và amino acid, và một RNA bền, ngắn và ngay lập tức RNA vận chuyển (tRNA) đã được xác định như một chất nhận đã được dự đoán trước .
Trong nhiều năm, RNA thông tin được tin là chịu trách nhiệm cho trình tự nucleotide liên tục trên DNA. Bởi vậy một sự ngạc nhiên hoàn toàn khi Phillip Sharp và Richard Roberts trình bày vào 1977 rằng trình tự mRNA có thể được xây dựng không liên tục trong hệ gene (gene phân mảnh, giải Nobel 1993). Điều đó cho thấy rằng phân tử RNA dài (tiền RNA, RNA dị biệt trong nhân) được cắt nối thành nhiều RNA ngắn trưởng thành,Sharp và Roberts vì thế đề xuất rằng trình tự mRNA,exon,dường như được cắt ra ngoài từ sự phiên mã sơ cấp,và tách ra,trong khi trình tự ở giữa, intron, bị suy thoái. Điều đó trực tiếp cho thấy sự sắp xếp không liên tục của trình tự mRNA trên DNA có liên hệ quan trọng với tiến hóa. Cộng thêm vào đó,quá trình cắt nối RNA có thể khác nhau giữa các mRNA con cháu, và nhiều hơn một protein bắt nguồn từ phiên mã sơ cấp (lựa chọn cách thức cắt nối).
Sự khám phá ra RNA có thể hoạt động như chất xúc tác đưa đến một triển vọng nhanh mới về vai trò của RNA (giải Nobel hóa học dành cho Sidney Alatman và Thomas Cech vào 1989). Đó là phát giác tức thời rằng RNA có thể xúc tác cho phản ứng tự nhân đôi và tổng hợp nên những phân tử RNA khác (ribozyme), mở đầu cho luồng ý kiến cho rằng RNA là nguyên liệu di truyền đầu tiên trên trái đất. Một " thế giới " RNA được tin là tồn tại trước khi DNA đón nhận vai trò là nguyên liệu di truyền then chốt, và RNA chuyển đến giữ vai trò liên lạc giữa DNA và protein. Sự khám phá chất xúc tác RNA không những liên hệ mật thiết với tiến hóa mà còn đề xuất được RNA giữ vai trò hoạt động nhiều hơn trong biểu hiện gene đã nhận ra từ sớm. Đến bây giờ một thiết lập tốt là RNA ribosome xúc tác hình thành liên kết peptide trong dịch mã.
Một số lớn phân tử RNA nhỏ làm việc qua liên kết với protein trong phức hợp Ribonucleoprotein (RNP). Có những protein không mã hóa ảnh hưởng tới phiên mã (ví dụ,ở người,snRNA 7SK bám vào nhân tố phiên mã), dịch mã (ví dụ, RNA SRP tại điểm nhận biết kết thúc dịch mã),tự nhân đôi (ví dụ, telomerase RNA) và cấu trúc nhiễm sắc thể (ví dụ,RNA XIST, nguyên nhân hội chứng bất hoạt nhiễm sắc thể X). Số khác điều hòa hoàn thiện RNA (ví dụ, RNA M1 trong RNAse P, snRNAs và snoRNAs) và phụ trách RNA (RNA chỉ đạo). Những hạt RNP khác nhau này bây giờ đang được mở rộng nghiên cứu để hiểu được những vai trò chuyên biệt của chúng trong tế bào.
Vào những năm đầu thập niên 1980 đã phát giác ở Escherichia coli có những phân tử RNA nhỏ (dài khoảng 100 nucleotide) có thể bám vào một trình tự bổ trợ trên mRNA và kiềm chế dịch mã 2 3.Hiện nay khoảng 25 trường hợp điều hòa lệch - hoạt động RNA vô nghĩa được nhắc đến ở E.coli 4.Điều hòa dịch mã bởi RNA vô nghĩa cũng xảy ra ở sinh vật nhân chuẩn được chứng minh lần đầu vào 1993 khi gene chi phối sự phát triển của bộ phận sinh dục của tuyến trùng Caenorhabditis elegans được nghiên cứu 5 6.Trong nhiều năm, trường hợp dữ liệu hoàn hảo này của điều hòa phiên mã bổ nhiệm được lưu tâm như một điều bỏ ngõ. Cơ chế thu nhận được nhiều điều kèm theo khi một ví dụ thứ hai về một RNA điều hòa nhỏ được tìm thấy ở C.elegans 7, bởi vì trong trường hợp này thỉnh thoảng các trình tự cũng hiện diện trong nhiều loài khác.Tuy nhiên, tình thế thay đổi một cách mãnh liệt khi một số lớn phân tử RNA nhỏ,goi là microRNA (miRNA),được phát giác vào 2001 8 9 10.
Trước khi khám phá ra can thiệp RNA ,một hiện tượng được gọi là gene (hay RNA) im lặng đã được liệt kê ở thực vật.Điều đáng chú ý là những thử nghiệm hồi 1990 có một dòng gene hợp nhất vào hệ gene (một gene vận chuyển) có thể không những giảm bớt hay kích thích hoạt động gene mà còn có thể kiềm chế biểu hiện của các trình tự tương đồng, một hiện tượng gọi là tương đồng phụ thuộc gene im lặng. Kiềm chế hoạt động gene có thể giữ chân mức độ phiên mã (phiên mã gene im lặng,TGS) 11 12 13, hoặc mức độ phiên mã bổ nhiệm (phiên mã bổ nhiệm gene im lặng, PTGS) 14 15 16 17 18. Một PTGS - như quá trình gọi là chế ngự cũng đã thiết lập ở nấm Neurospora crassa 19. Phân tích sự nhiễm virus ở thực vật đem lại cái nhìn thấu đáo về cơ chê của PTGS 20 21.Tuy nhiên, mặc dù rõ ràng rằng RNA giữ vai trò then chốt trong gene im lặng, hiện tượng vẫn còn bí ẩn cho đến lúc khám phá can thiệp RNA cung cấp lời giải thích ngoài tầm mong đợi với nhiều hệ quả thâm thúy.
Sự khám phá can thiệp RNA[sửa]
Andrew Fire và Craig Mello đã công bố nghiên cứu hé lộ về cơ chế can thiệp RNA trên Nature vào năm 1998 22. Nó được biết sớm hơn với tên gọi RNA vô nghĩa 23 , nhưng rõ ràng RNA có nghĩa 24 cũng có thể là gene im lặng,kết quả thu thập trái ngược với phương thức thông thường nhất. Tuy vây,nhờ có sự thật là cả RNA có nghĩa lẫn RNA vô nghĩa có thể là nguyên nhân của sự im lặng, Mello đã chứng tỏ rằng cơ chế không thể chỉ sự bắt cặp giữa RNA im lặng với mRNA,và ông ấy đặt ra thuật ngữ can thiệp RNA cho cái cơ chế chưa biết 25.
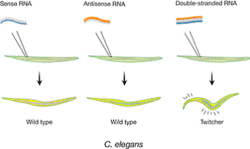
Trên tạp chí Nature, Fire va Mello đã thử nghiệm kiểu hình ảnh hưởng của việc tiêm RNA vào bộ phân sinh dục của C.elegan.Họ thiết lập một RNA có nghĩa/vô nghĩa, nhưng cả RNA có nghĩa hay vô nghĩa đứng tách riêng ra, bởi vì họ đã dự đoán kiểu hình (Hình1).Hơn nữa chỉ tiêm mạch kép RNA (dsRNA) dẫn tới một hiệu ứng thua lỗ của mRNA đích. Fire và Mello đã diễn tả một loạt những kết quả không quá phức tạp mà dự đoán trước được trong nhiên cứu. Những kết quả chính có thể tóm tắt như sau:
Đầu tiên,im lặng là hiệu ứng gây nên bởi sự tiêm mạch kép RNA, hơi hơi hay không phải tất cả RNA mạch đơn.
Thứ hai, im lặng đặc trưng cho một mRNA tương đồng với RNA mạch kép, các mRNA khác không ảnh huởng gì.
Thứ ba, RNA mạch kép chịu trách nhiệm cho trình tự mRNA trưởng thành; cả intron lẫn trình tự đoạn khởi động là phản ứng đáp ứng. Điều này biểu thị một sự phiên mã bổ nhiệm, coi như là cơ chế của tế bào chất.
Thứ tư, mRNA đích xuất hiện đề xuất cho rằng nó bị suy thoái.
Thứ năm, chỉ vài phân tử mạch kép RNA trên một tế bào là vừa đủ hoàn tất sự im lặng. Điều này biểu thị mRNA mạch kép đã đuợc khuyếch đại và /hoặc hoạt động xúc tác hơn là phản ứng.
Thứ sáu, hiệu ứng RNA mạch kép có thể trải rộng giữa các mô thậm chí ngay đến các dòng mô con, gợi ý một sự di truyền hiệu ứng giữa các tế bào.
Hơn nữa, Fire và Mello đã lưu ý rằng can thiệp RNA (RNAi) có thể cung cấp lời giải thích cho hiện tượng nghiên cứu ở thực vật trong nhiều năm: phiên mã bổ nhiệm gene im lặng(PTGS)
Sau cùng, họ kết thúc các trang tạp chí bằng sự suy đoán về một khả năng có thể rằng "RNA mạch kép có thể được sử dụng bởi tổ chức thay cho gene im lặng sinh lý".
Trên
trang
Nature,
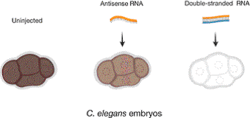
Fire
và
Mello
đã
không
nhận
được
một
thế
đứng
vững
chắc
trong
số
báo
đó
dù
cho
RNA
mạch
kép
hoạt
động
theo
cơ
chế
phiên
mã
hay
cơ
chế
phiên
mã
bổ
nhiệm.
Tuy
nhiên
trong
một
nghiên
cứu
sau
đó
trên
tờ
PNAS
xuất
bản
cùng
năm,
Fire
đã
cung
cấp
bằng
chứng
chắc
chắn
củng
cố
rằng
mRNA
là
đích
nhắm
của
RNA
mạch
kép
(nhận
ra
qua
mạch
bổ
trợ),
và
mRNA
đích
bị
suy
thoái
trước
khi
dịch
mã,
ví
dụ
RNA
mạch
kép
sử
dung
RNA
đích
tác
động
lến
mức
độ
phiên
mã
bổ
nhiệm 26.
Ông
ta
đã
diễn
tả
một
phương
thức
chuyên
biệt
cho
thấy
bằng
cách
nào
mà
RNA
mạch
kép
có
thể
thực
hiện
chức
năng
xúc
tác
theo
kiểu
mRNA
đích
tương
đồng
của
sự
suy
thoái.
Phương
thức
này
khác
biệt
một
cách
mơn
trớn
so
với
phương
thức
vô
nghĩa
đơn
giản
tại
cùng
thời
điểm,
không
chỉ
dự
đoán
mối
tương
tác
giữa
một
RNA
mạch
đơn
im
lặng
và
mRNA.
Nó
có
lẽ
được
tổng
hợp
lại
trên
tờ
PNAS,
Fire
cũng
dự
đoán
khả
năng
cơ
chế
can
thiệp
RNA
có
thể
là
một
"chiến
thuật"
đặc
biệt
gần
như
sự
đề
kháng
virus
ở
các
tổ
chức
cấp
thấp
(được
so
sánh
với
phản
ứng
đáp
ứng
interferon
toàn
diện
của
động
vất
có
vú).
Trong vòng một năm, sự hiện diện của RNA im lặng được cung cấp tư liệu ở nhiều tổ chức khác nhau, đáng kể là sâu cải, trùng trypanosome, thực vật, planaria, thủy tức và cá ngựa 27. Những thí nghiệm đầu tiên trong môi trường nuôi cấy tế bào động vật có vú, không thể đưa ra một phản ứng đáp ứng can thiệp RNA có hiệu lực và chuyên biệt bởi vì một phản ứng sính lý tiền trội của tế bào đối với mRNA dài. Tuy nhiên,khi tế bào bị bóc trần, mạch kép RNA ngắn dài 21 nucleotide, cũng đã là một trình tự đích im lặng có hiệu lực chứa trong những tế bào này 28. Vì vậy,phát sinh hiện tượng can thiệp RNA ở các tế bào nhân chuẩn đã được chứng minh một cách nhanh chóng;một ngoại lệ đáng chú ý là nấm sinh sản, Saccharomyces cerevisiae.
Sự soi rạng cơ chế can thiệp RNA[sửa]
Một thời gian ngắn sau khi khám phá ra can thiệp RNA ,nhận thấyPTGS ở thực vật có tương quan với một quần thể RNA nhỏ (mỗi RNA nhỏ dài 25 nucleotide), và chính RNA này chứa cả trình tự có nghĩa lẫn vô nghĩa 29. Có đề xuất rằng RNA này xác định PTGS.Hơi sớm nhưng theo sau sự khám phá ra can thiệp RNA ở tế bào động vật,quần thể RNA nhỏ nói lên rằng RNA mạch kép cũng đã làm quen PTGS ở thực vật 30.
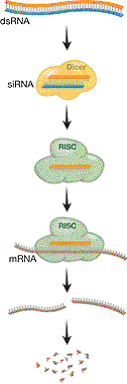
Hóa sinh can thiệp RNA được làm sáng tỏ hơn nữa trong một hệ thống invitro dựa trên những phần chiết phôi ruồi giấm 27.Có thể nhận thấy RNA mạch kép được hoàn thiện tới một đoạn RNA mạch kép dài 21-23 nucleotide 31, một sự đồng thuận tuyệt vời với dữ liệu của PTGS ở thực vật 29.Từ đó đã đề xuất rằng mạch kép RNA ngắn,siRNA chỉ đạo phân tách mRNA.Rồi thì,Fire và Mello đã có thể theo dõi quá trình invivo 32. Họ thiết lập một RNA mạch kép dài được phân tách thành những RNA nhỏ (chiều dài khoảng 25 nucleotide), và RNA vô nghĩa gây nên sự suy thoái của mRNA thông qua bắt cặp base với mRNA.Vì vậy tạo nên mạch kép RNA,liên hệ với hiệu ứng trọng lượng phân tử thấp.
Cơ chế phân tử liến quan với can thiệp RNA sau đó đã được phát giác (Hình 3).Trong hệ thống invitro,xây dưng trên môi trường nuôi cấy tế bào ruồi giấm,giải thích rằng một phức hợp lớn gọi là RISC (RNA -làm giảm bớt sự im lặng phức tạp) là đích nhắm của mRNA thông qua một RNA vô nghĩa ngắn,và rằng mRNA bị phân tách rồi suy thoái 33. Sau nữa,nhận thấy rằng RISC chứa đựng ít nhất một thành viên của dòng protein a-gô-nôt,dòng protein hoạt động như một endonuclease và cắt mRNA (ngày nay, thường được tham khảo như chức năng cắt thành từng lát mỏng).Điều đó cũng giải thích rằng Ribonulcease -III,tương tự nuclease, gọi là Dicer chịu trách nhiệm hoàn thiện mạch kép RNA thành RNA ngắn 34.Trong một hệ thống chắc chắc,đặc biệt là thực vật,bộ phận sinh dục và nấm,một RNA phụ thuộc RNA polymerase (RdRP) đóng vai trò quan trọng trong di truyền và /hoặc khuyếch đại siRNA 35 .
Vì thế, chỉ trong vài năm một lượng thông tin đồ sộ tích lũy được trên các protein chuyên biệt , phức hợp protein liên quan tới can thiệp RNA và tường tận cơ sở phân tử các bước đặc biệt của quá trình 36 37 38 39.
Ý nghĩa sự khám phá can thiệp RNA[sửa]
Hiển nhiên là từ lúc khám phá ra ý nghĩa can thiệp RNA đã vấp phải phản đối.Những hệ quả nghiên cứu xa hơn được tóm tắt như sau: (Hình 4)
1. Can thiệp RNA chống lại sự nhiễm virus:
Phát hiện của Fire và Mello tế bào có thể hoàn thiện tiêm RNA mạch kép và loại trừ RNA mạch đơn tưong đồng giúp đề xuất can thiệp RNA cấu tạo nên cơ chế bảo vệ chống lại sự xâm nhập của virus. Người ta đã sớm nhận ra tế bào thực vật có cơ chế bảo vệ chống lại sự xâm nhập của virus dựa trên hiện tượng PTGS 40 41. Khi bắt đầu đã lộ ra PTGS là một lưỡng trị thực vật thay cho can thiệp RNA, công việc sớm này ở thực vật ủng hộ đề xuất can thiệp RNA liên quan tới sự bảo vệ tế bào chống lại sự xâm nhập của virus. Hiện nay,chúng ta biết rằng cơ chế chống đối virus này làm việc ở thực vật,bộ phận sinh dục và sâu bọ bay,trái lại vẫn chưa rõ thích hợp thế nào với động vật có xương sống, kể cả người.
2. Can thiệp RNA bảo đảm ổn định hệ gen bằng cách đón giữ các phần tử di động im lặng:
Người ta đã đề xuất sớm rằng RNAi/PTGS ở C.elegans và thực vật có thể cản trở hoạt động của transposon (các nhân tố di động trong hệ gen).Tiếp theo, có thể nhận thấy các thành phần của cơ chế can thiệp RNA bị đột biến ở C.elegans, transposon được hoạt hóa và nhân tố di động này là nguyên nhân xáo trộn chức năng hệ gene 42 43.Từ đó đề xuất rằng transposon-chứa đựng những vùng hệ gen chứa cả mạch DNA được phiên mã,RNA mạch kép được định dạng, và quá trình can thiệp RNA loại trừ những sản phẩm không ưa thích. Như thể là RNA mạch kép ngắn cũng có thể chỉ đạo điều hành nhiễm sắc tử và tăng cường phiên mã (nhìn bên dưới), điều này sẽ là một phương thức khác đón giữ lam bất hoạt transposon (nhìn phía bên dưới 4). Ngay nếu như cơ chế này vẫn chưa được phát giác,thì rõ ràng rằng nếu cơ chế can thiệp RNA không có hiệu lực,các transposon không bi giữ lại bởi kiểm soát dưới, nó có thể bắt đầu nhảy và là nguyên nhân của hiệu ứng có hại của hệ gen.
Điều đó chứng tỏ RNA im lặng có thể tái hiện một sự "bảo vệ miễn dịch" của hệ gene 44.Gần 50% hệ gene chúng ta có virus và nhân tố transposon mà chúng phải xâm lấn hệ gene chúng ta trong một khóa học tiến hóa. Cơ chế can thiệp RNA có thể nhận ra sự xấm lấn của virus RNA mạch kép (hoặc mạch kép sao chép định dạng từ virus RNA) và tăng cường lây nhiễm bởi sự suy thoái RNA. Hệ thống can thiệp RNA vì thế chia xẻ những điểm đặc biệt quan trọng với hệ thống miễn dịch động vật có xương sống: nó nhận ra các điểm xâm lấn (RNA mạch kép), nuôi dưỡng các phản ứng đáp ứng ban đầu và tiếp theo khuyếch đại để loại trừ nhân tố ngoại lai.
3. Can thiệp RNA như cơ chế kiềm chế tổng hợp protein và điều khiển sự phát triển của tổ chức:
Ngay sau khi khám phá ra RNA ngắn là hiệu ứng của can thiệp RNA, người ta nhận thấy rằng có một lớp RNA trong hệ gene cùng một kích thước ở bộ phận sinh dục,ở sâu bọ bay, ở chuột và người; RNA nhỏ này gọi là microRNA (miRNA) 8 9 10. Thực vật cũng chứa đựng một lớp phân tử RNA này trong hệ gene 45. Sự soi rạng miRNA mở đầu cho những nghiên cứu sôi nổi trong tự nhiên về lớp phân tử RNA này. Các RNA của C.elegans-lin4 và let7.RNAs được chú ý như nguyên mẫu, và những ví dụ cho trường hợp thỉnh thoảng phát giác ở một vài tổ chức 46. miRNA nhỏ được hoàn thiện từ thể kẹp tóc lớn hơn-như điềm báo trước từ can thiệp RNA-như cơ chế 47 48(Hình 4). miRNAs có thể điều hòa biểu hiện gene bằng cách bắt cặp base với mRNA, kết quả là suy thoái mRNA hay tăng cường dịch mã.Hiện nay,ước lượng có khoảng 500 miRNAs ở tế bào động vật có vú,và khoảng 30% điều hòa bởi miRNAs. Điều đó cho biết miRNAs đóng vai trò quan trọng trong suốt qua trình phát triển ở thực vật, C.elegans và động vật có vú. Vì thế,miRNAs phụ thuộc biểu hiện gene đặc trưng cho nguyên tắc cơ bản mới của điều hòa gene.Tuy nhiên, ý nghĩa đầy đủ của RNAs điều hòa nhỏ có lẽ vẫn chưa rõ ràng.
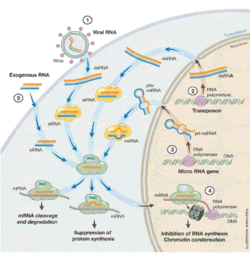
4. Can thiệp RNA như cơ chế giữ gìn nhiễm sắc tử cô đặc và tăng cừơng phiên mã:
Những nghiên cứu ở thực vật cho thấy gene im lặng có thể giữ chân mức độ phiên mã (TGS). Sau khi khám phá ra can thiệp RNA, ngay lập tức người ta thấy TGS ở thực vật điều hành thông qua can thiệp RNA như cơ chế 49 50. Ở nấm sinh sản bằng cách phân đôi Schizosaccharomyces pombe 51 52, muộn hơn là ruồi giấm và động vật có xương sống, đôi khi có những quá trình giữ cho vùng dị nhiễm sắc được cô đặc và tăng cường phiên mã. Cộng thêm vào đó, cơ chế can thiệp RNA điều hòa hoạt động những gene nằm trực tiếp kế bên khối nhiễm sắc tử cô đặc. Hiện tượng này khó hiểu ở mức độ phân tử,mặc dù biến đổi histone, điểm bám chuyên biệt của protein làm cô đặc nhiễm sắc tử (HP1) và methyl hóa DNA đều đóng vai trò quan trọng 46. Tuy thế, hiển nhiên hoạt động này trên nhiễm sắc tử là tối quan trọng cho chức năng chính xác của hệ gene và bảo quản hệ gene được nguyên vẹn.
5. Can thiệp RNA cống hiến một công cụ thí nghiệm mới để kiềm chế gene chuyên biệt.
Mục tiêu hoạt động của can thiệp RNA trực tiếp đề xuất rằng hiện tượng này có thể sử dụng như một phương pháp chung để thúc đẩy gene chuyên biệt và trông thấy kết quả hiệu ứng kiểu hình. Ngay lúc rõ ràng hoạt đông này có thể được hoàn thành như một kiểu hiệu lực rằng thực chất bất cứ gene nào trong tổ chức đều có thể nghiên cứu được chức năng. Sau nghiên cứu ban đầu ở C.elegans, kỹ thuật này gần như có thể ứng dụng được từ tế bào đến hầu hết các tổ chức khác, kể cả tế bào động vật có vú. Chủ đích này của gene im lặng do can thiệp RNA vừa có một ảnh hưởng to lớn trong việc nghiên cứu chức năng các gene riêng biệt. Kỹ thuật này bây giờ được khai thác không những trong nuôi cấy tế bào mà còn trong cấy chuyển gene. Khung DNA được gửi gắm vào trong các tổ chức dưới sự kiểm soát của đoạn khởi động (promoter), và RNA mạch kép cấu trúc thể kẹp tóc được sản xuất và hoàn thiện hơn nữa để đạt tới những hiệu ứng chuyên biệt trong điều hòa hoạt động gene
6. Can thiệp RNA phải là một giải quyết hữu ích trong điều trị bệnh di truyền trong tương lai:
Khả năng để đạt tới can thiệp RNA chi phối điều hoà hoạt động gene trong cấy chuyển gene đã khuyến khích nhiều cuộc khảo sát tỉ mỉ, mặt khác có thể là một lựa chọn hữu dụng trong điều trị y học 53 54.Những kết quả hứa hẹn đã được trình bày ở một vài động vật điển hình 55 56 57 58 và ngay cả trong những thử nghiệm lâm sàng gần đây, nhưng hãy còn quá sớm để nói trước kết quả của những thử thách đầy cam go này.
Kết luận[sửa]
Sự khám ra tế bào có một cơ chế đặc biệt nhằm tăng cường biểu hiện của các gene tương đồng bằng việc nhận ra và hoàn thiện mạch kép RNA đã vượt quá mong đợi và mở rộng hiểu biết của chúng ta về kiểm soát gene. Đặc biệt, cơ chế can thiệp RNA có thể sử dụng RNA mạch kép vào trong tế bào như thể là RNA mạch kép con cháu trong tế bào. Sự phát triển của một tổ chức và chức năng chính xác của mỗi tế bào và mô tùy thuộc vào một cơ chế can thiệp RNA còn nguyên vẹn. Sự nhiễm virus RNA có thể bị cản trở bởi can thiệp RNA, đăc biệt ở thực vật và động vật bậc thấp, những nhân tố ngoại lai trong hệ gene (virus và transposon) có thể bị giữ im lặng. Cuối cùng,s ự khám phá ra can thiệp RNA không chỉ cung cấp cho chúng ta một công cụ thí nghiệm mạnh mẽ mới để nghiên cứu chức năng của các gene mà còn nuôi dưỡng những mong đợi của chúng ta về những ứng dụng tương lai của can thiệp RNA trong y học.
Tài liệu tham khảo[sửa]
1: Avery, OT, MacLeod, CM and McCarty, M (1944). Studies on the chemical nature of the substance inducing transformation of Pneumococcal types. J. Exp. Med. 79, 137-158.
2: Mizuno, T, Chou, M-Y, and Inouye, M (1984). A unique mechanism regulating gene expression: Translational inhibition by a complementary RNA transcript (micRNA). Proc. Natl Acad. Sci. 81, 1966-1970.
3: Nordström, K, and Wagner, EG (1994). Kinetic aspects of control of plasmid replication by antisense RNA, Trends Biochem. Sci. 19, 294-300.
4: Gottesman, S (2004). The small RNA regulators of Escherichia coli: Roles and mechanisms. Ann. Rev. Microbiol. 58, 303-328.
5: Lee, RC, Feinbaum, RL and Ambros, V (1993). The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense comlementarity to lin-14. Cell 75, 843-854.
6: Wightman, B, Ha, I and Ruvkun, G (1993). Posttranscriptional regulation of the heterochronic gene lin-14 by lin-4 mediates temporal pattern formation in C. elegans. Cell 75, 855-862.
7: Reinhart, BJ, Slack, FJ, Basson, M, Pasquinelli, AE, Bettinger, JC, Rougvie, HR, Horvitz, HR and Ruvkun, G (2000). The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditis elegans. Nature 403, 901-906.
8: Lee, RC and Ambros, V (2001). An extensive class of small RNAs in Caenorhabditis elegans. Science 294, 862-864.
9: Lau, NC, Lim, LP, Weinstein, EG, and Bartel, DP (2001). An abundant class of tiny RNAs with probable regulatory roles in Caenorhabditis elegans. Science 294, 858-862.
10: Lagos-Quintana, M, Rauhut, R, Lendeckel, W and Tuschl, T (2001). Identification of novel genes coding for small expressed RNAs. Science 294, 853-858.
11: Matzke M, Primig, M, Trnovsky, J and Matzke, A (1989). Reversible methylation and inactivation of marker genes in sequentially transformed plants. EMBO J. 8, 643-649.
12: Wassenegger, M, Heimes, S, Riedel, L and Sänger H (1994). RNA-directed de novo methylation of genomic sequences in plants. Cell 76, 567-576.
13: Park, Y-D, Moscone, EA, Iglesis, VA, Vaucheret, H , Matzke, AJM and Matzke, MA (1996). Gene silencing mediated by promoter homology occurs at the level of transcription and results in meiotically heritable alterations in methylation and gene activity. Plant J. 9, 183-194.
14: Napoli, C, Lemieux, C. and Jorgensen, R (1990). Introduction of a chimeric chalcone synthase gene into petunia results in reversible co-suppression of homologous genes in trans. Plant Cell 2, 279-289.
15: van der Krol, A, Mur, L. Beld, M, Mol, JNM, and Stuitje, AR (1990). Flavonoid genes in petunia: Addition of a limited number of gene copies may lead to a suppression of gene expression. Plant Cell 2, 291-299.
16: Smith, CJS, Watson, CF, Bird, CR, Ray, J Schuch, W and Grierson, D (1990). Expression of a truncated tomato polygalacturonase gene inhibits expression of the endogenous gene in transgenic plants. Mol. Gen. Genet. 224, 447-481.
17: de Carvalho, F, Gheyson, G, Kushnir, S. van Montagu, M, Inzé, D et al. (1992). Suppression of beta-1,3-glucanase transgene expression in homozygous plants. EMBO J. 11, 2595-2602.318.
18: van Blokland, K, van der Geest, N, Mol, J, and Kooter, J (1994). Transgene-mediated suppression of chalcone synthase expression in Petunia hybrida results from an increase in RNA turnover. Plant J. 6, 861-877.
19: Romano, N and Macino, G (1992). Quelling: Transient inactivation of gene expression in Neurospora crassa by transformation with homologous sequences. Mol. Microbiol. 6, 3343-3353.
20: Lindbo, J, Silva-Rosales, L, Proebsting, W and Dougherty, W (1993). Induction of a highly specific antiviral state in transgenic plants: Implications for regulation of gene expression and virus resistance. Plant Cell 5, 1749-1759.
21: Dougherty, WG and Parks, TD (1995). Transgenes and suppression: telling us something new? Curr. Opin. Cell Biol. 7, 399-405.
22: Fire, A, Xu, S, Montgomery, MK, Kostas, SA, Driver, SE, and Mello, CC (1998). Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 391, 806-811.
23: Izant, JG and Weintraub, H (1984). Inhibition of thymidine kinase gene expression by anti-sense RNA: A molecular approach to genetic analysis. Cell 36, 1007-1015.
24: Guo, S and Kemphues, KJ (1995). Par-1, a gene required for establishing polarity in C. elegans embryos, encodes a putative Sex/Thr kinase that is asymmetrically distributed. Cell 81, 611-620.
25: Rocheleau, CE, Downs WD, Lin, R, Wittman, C, Bei, Y, Cha, YH, Ali, M, Priess JR and Mello, CC (1997), Wnt signaling and an APC-relatred gene specify endoderm in early C. elegans embryos. Cell 90, 707-716.
26: Montgomery, MK, Xu S, and Fire A (1998). RNA as target of double-stranded RNA-mediated genetic interference in Caenorhabditis elegans. Proc. Natl Acad. Sci. 95, 15502-15507.
27: Tuschl, T, Zamore, PD, Lehmann, R, Bartel, DP, and Sharp PA (1999). Targeted mRNA degradation by double-stranded RNA in vitro. Genes Devel. 13, 3191-3197.
28: Elbashir, SM, Harborth, J, Lendeckel, W, Yalcin, A. Weber, K, and Tuschl, T (2001). Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature 411, 494-498.
29: Hamilton, AJ and Baulcombe, DC (1999). A species of small antisense RNA in posttranscriptional gene silencing in plants. Science 286, 950-952.
30: Waterhouse, PM, Graham, MW, and Wang, M-B (1998). Virusa resistance and gene silencing in plats can be induced by simultaneous expression of sense and antisense RNA. Proc. Natl Acad. Sci. 95, 13959-13964.
31: Zamore, PD, Tuschl, T, Sharp, PA, and Bartel, DP (2000). RNAi: Double-stranded RNA directs the ATP-dependent cleavage of mRNA at 21 to 23 nucleotide intervals. Cell 101, 25-33.
32: Parrish, S, Fleenor, J, Xu S, Mello, C and Fire A (2000). Functional anatomy of a dsRNA trigger: Differential requirements for the two trigger strands in RNA interference. Molec. Cell 6, 1077-1087.
33: Hammond, SM, Bernstein, E, Beach, D, and Hannon, GJ (2000). An RNA-directed nuclease mediates post-transcriptional gene silencing in Drosophila cells. Nature 404, 293-296.
34: Bernstein, E, Caudy, AA, Hammond, SM, and Hannon, GJ (2001). Role for a bidentate ribonuclease in the initiation step of RNA interference. Nature 409, 363-366.
35: Cogoni C and Macino G (1999). Gene silencing in Neurospora crassa requires a protein homologus to RNA-depednet RNA polymerase. Nature 399, 166-169.
36: Hannon, GJ (2002), RNA interference. Nature 418, 244-251.
37: Mello, CC and Conte Jr, D (2004). Revealing the world of RNA interference. Nature 431, 338-342.
38: Meister, G and Tuschl, T (2004). Mechanisms of gene silencing by double-stranded RNA. Nature 431, 343-349.
39: Hammond, SM (2005). Dicing and slicing. The core machinery of the RNA interference pathway. FEBS Lett. 579, 5822-5829.
40: Covey, S, Al-Kaff, N. Lángara, A and Turner, D (1997). Plants combat infection by gene silencing. Nature 385, 781-782.
41: Ratcliff, F, Harrison, B and Baulcombe, D (1997). A similarity between viral defence and gene silencing in plants. Science 276, 1558-1560.
42: Ketting, RF, Haverkamp, TH, van Luenen HG, and Plasterk, RH (1999). Mut-7 of C. elegans, required for transposon silencing and RNA interference, is a homolog of Werner syndrome helicase and RNase D. Cell 99, 133-141.
43: Tabara, H, Sarkissian M, Kelly WG, Fleenor, J, Grishok, A, Timmons, L, Fire, A and Mello CC (1999). The rde-1 gene, RNA interference, and transposon silencing in C. elegans. Cell 99, 123-132.
44: Plasterk, RHA (2002). RNA Silencing: The Genome's Immune System. Science 296, 1263-1265.
45: Reinhart, BJ, Weinstein, EG, Rhodes, MW, Bartel, B and Bartel DP (2002). MicroRNAs in plants. Genes Dev. 16, 1616-1626.
46: Sharp, PA (2006). The Biology of Short RNAs. In "RNA World", Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY.
47: Murchison, EP and Hannon, GJ (2004). miRNAs on the move: miRNA biogenesis and the RNAi machinery. Curr. Opin. Cell Biol. 16, 223-229.
48: Zamore, PD and Haley, B (2005). Ribo-gnome: The Big World of Small RNAs. Science 309, 1519-1524.
49: Mette, MF, Aufsatz, W, van der Winden, J, Matzke, M and Matzke A (2000). Transcriptional gene silencing and promoter methylation triggered by double stranded RNA. EMBO J. 19, 5194-5201.
50: Sijen, T, Vijn, I, Rebocho, A, van Blokland R, Roelofs, D et al. (2001). Transcriptional and posttranscriptional gene silencing are mechanistically related. Curr. Biol 11, 436-440.
51: Hall, IM, Shankaranarayana, GD, Noma K, Ayoub, N, Cohen, A and Grewal SI (2002). Establishment and maintenance of a heterochromatic domain. Science 297, 2232-2237.
52: Volpe, TA, Kidner, C, Hall, IM, Teng, G, Grewal, SI and Martienssen, RA (2002). Regulation of heterochromatic silencing and histone H3 lysine-9 methylation by RNAi. Science 297, 1833-1837.
53: Dorsett, Y and Tuschl, T (2004). siRNAs: Applications in functional genomics and potential as therapeutics. Nature Reviews 3, 318-329.
54: Hannon, GJ and Rose, JJ (2004). Unlocking the potential of the human genome with RNA interference. Nature 431, 371-378.
55: Soutschek, J et al. (2004). Therapeutic silencing of an endogenous gene by systematic administration of modified siRNAs. Nature 432, 173-178.
56: Morrisey, DV et al. (2005). Potent and persistent in vivo anti-HBV activity of chemically modified siRNAs. Nat. Biotechnol. 23, 1002-1007.
57: Palliser, D (2006). An siRNA-based microbicide protects mice from lethal herpes simplex virus infection. Nature 439, 89-94.
58: Zimmermann TS et al. (2006). RNAi-mediated gene silencing in non-human primates. Nature 441, 111-114.
Lời cám ơn của người viết[sửa]
Tôi lấy làm biết ơn Annika Röhl đã thiết kế các hình vẽ và Adam Smith viết lời bình cho đề mục.
Nguồn[sửa]
- Bertil Daneholt, Giáo sư Di truyền học Phân Tử,Viện nghiên cứu Karolinska, Stockholm, Chủ tịch hội đồng giải Nobel.
- Huỳnh Như Ngọc Hiển, SHVN