Tỉ lệ logarit
Trong tính toán, nhiều khi ta cần phải chuyển phạm vi của một đại lượng để tiện so sánh, đối chiếu và phân tích. Có thể phóng to kích thước của một hình lớn gấp m lần hoặc thu nhỏ n lần để xem xét. Với dãy số liệu 0,01; 0,1; 10; 100; 1000; 10.000; 100.000; 1.000.000.000 nếu thực hiện giảm với tỉ lệ 1/10 thì ta có dãy số nhỏ hơn 10 lần như sau: 0,001; 0,01; 1; 10; 100; 1000; 10.000; 100.000.000. Xét cho cùng ta vẫn có một dãy số phức tạp. Nếu lấy logarit thập phân các số từ dãy số liệu ban đầu đó ta có dãy số sau: -2; -1; 1, 2, 3, 4, 5, 9. Rõ ràng dãy số ban đầu đã được chuyển về dãy số dễ theo dõi và dễ kiểm soát hơn.
Thực tế cho thấy, logarit thực sự có thể chuyển các đại lượng có phạm vi rộng hoặc quá nhỏ về phạm vi có thể kiểm soát được. Điều này được minh họa bởi thang đo pH, thang độ Richter và thang đo decibel - sự thể hiện cụ thể hóa của tỉ lệ logarit. Chúng tôi sẽ phân tích cụ thể tỉ lệ logarit qua thang đo pH.

Theo
tài
liệu
[7],
“Trong
nước
nguyên
chất
cũng
như
trong
bất
kì
dung
dịch
nào
luôn
luôn
có
mặt
các
ion
H+
và
OH-”
và
“nồng
độ
của
các
ion8
H+
và
OH-
biểu
diễn
được
tính
axit
và
bazơ
của
dung
dịch”.
Tuy
nhiên,
nồng
độ
ion
H+
của
dung
dịch
thường
thay
đổi
trong
phạm
vi
rất
nhỏ,
khó
kiểm
soát
từ
10-14
mol
/
l
cho
đến
100
mol
/l
.
Và
theo
[7]:
“Môi
trường
của
dung
dịch
có
thể
biểu
diễn
bằng
đại
lượng
thuận
lợi
hơn:
đại
lượng
chỉ
số
hydro
pH:
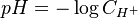 ”
([7],
tr.119).
Vậy,
chỉ
số
hydro
pH
thuận
lợi
hơn
nồng
độ
ion
H+
thể
hiện
ở
chỗ
nào?
”
([7],
tr.119).
Vậy,
chỉ
số
hydro
pH
thuận
lợi
hơn
nồng
độ
ion
H+
thể
hiện
ở
chỗ
nào?
Qua phân tích, chúng tôi nhận thấy một số điểm thuận lợi sau:
+
Thứ
nhất,
theo
công
thức
tính
pH
thì
pH
là
giá
trị
của
hàm
số
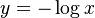 ,
với
x
đại
diện
cho
nồng
độ
ion
H+
và
giá
trị
của
x
thuộc
đoạn
[1014;100].
Mà
ta
biết:
hàm
số
,
với
x
đại
diện
cho
nồng
độ
ion
H+
và
giá
trị
của
x
thuộc
đoạn
[1014;100].
Mà
ta
biết:
hàm
số
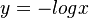 là
hàm
nghịch
biến
trên
khoảng
0;
nên
mỗi
giá
trị
x
thuộc
đoạn
[1014;100]
có
duy
nhất
một
giá
trị
pH
tương
ứng
thuộc
đoạn
[0;14]
và
ngược
lại.
Từ
đó
cho
thấy
phạm
vi
hẹp
[1014;100]
của
nồng
độ
ion
H+
đã
được
đưa
về
phạm
vi
dễ
theo
dõi
hơn
[0;14].
là
hàm
nghịch
biến
trên
khoảng
0;
nên
mỗi
giá
trị
x
thuộc
đoạn
[1014;100]
có
duy
nhất
một
giá
trị
pH
tương
ứng
thuộc
đoạn
[0;14]
và
ngược
lại.
Từ
đó
cho
thấy
phạm
vi
hẹp
[1014;100]
của
nồng
độ
ion
H+
đã
được
đưa
về
phạm
vi
dễ
theo
dõi
hơn
[0;14].
+
Thứ
hai,
dựa
vào
chỉ
số
pH
ta
cũng
có
thể
xác
định
được
tính
axit
hay
bazơ
của
dung
dịch.
Thay
vì
so
sánh
nồng
độ
ion
H+
10-7
mol
/l
ta
so
sánh
chỉ
số
pH
với
7
(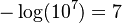 ).
Theo
đó,
nếu
dung
dịch
có
pH
=
7
thì
có
môi
trường
trung
tính,
dung
dịch
có
pH
>
7
thì
có
môi
trường
bazơ
và
dung
dịch
có
pH<7
thì
có
môi
trường
axit.
).
Theo
đó,
nếu
dung
dịch
có
pH
=
7
thì
có
môi
trường
trung
tính,
dung
dịch
có
pH
>
7
thì
có
môi
trường
bazơ
và
dung
dịch
có
pH<7
thì
có
môi
trường
axit.
+ Thứ ba, từ chỉ số pH hoàn toàn có thể tính lại được nồng độ ion H+ của dung dịch theo công thức CH+=10-pH.
Như vậy, không chỉ được tính toán trong Toán học, logarit còn được ứng dụng để xác định chỉ số pH của dung dịch. Từ ứng dụng tính pH đó ta thấy logarit nổi bật với vai trò công cụ cho phép chuyển đại lượng có phạm vi nhỏ về phạm vi có thể kiểm soát được.
Trong
khi
nồng
độ
ion
H+
đại
diện
cho
đại
lượng
có
phạm
vi
nhỏ,
hẹp
thì
cường
độ
các
trận
động
đất,
cường
độ
của
âm
thanh
là
những
trường
hợp
điển
hình
cho
đại
lượng
có
phạm
vi
tương
đối
rộng.
Chẳng
hạn,
độ
mạnh
của
các
trận
động
đất
dao
động
trong
khoảng
I0
cho
đến
800,000,000I0
với
I0
là
biên
độ
dao
động
bé
hơn
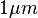 trên
máy
đo
địa
chấn
được
đo
bằng
địa
chấn
kế
đặt
xa
cách
tâm
chấn
100km.
trên
máy
đo
địa
chấn
được
đo
bằng
địa
chấn
kế
đặt
xa
cách
tâm
chấn
100km.
Logarit được ứng dụng để xác định độ chấn động của trận động đất và độ to nhỏ của âm thanh theo các công thức:
-
Độ
chấn
động
của
các
trận
động
đất:
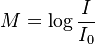 (đơn
vị
độ
Richter),
trong
đó
(đơn
vị
độ
Richter),
trong
đó
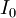 là
biên
độ
dao
động
chuẩn,
I
là
biên
độ
dao
động
được
đo
bằng
địa
chấn
kế
đặt
xa
cách
tâm
chấn
100km.
là
biên
độ
dao
động
chuẩn,
I
là
biên
độ
dao
động
được
đo
bằng
địa
chấn
kế
đặt
xa
cách
tâm
chấn
100km. -
Cường
độ
âm
thanh:
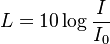 (đơn
vị
decibel),
trong
đó
I
là
năng
lượng
truyền
đi
bởi
sóng
âm
trong
một
đơn
vị
thời
gian
và
qua
một
đơn
vị
diện
tích
bề
mặt
vuông
góc
với
phương
truyền
(đơn
vị
đo
là
W/m2);
I0
là
cường
độ
của
âm
ở
ngưỡng
nghe
(I0=10-12W/m2).
(đơn
vị
decibel),
trong
đó
I
là
năng
lượng
truyền
đi
bởi
sóng
âm
trong
một
đơn
vị
thời
gian
và
qua
một
đơn
vị
diện
tích
bề
mặt
vuông
góc
với
phương
truyền
(đơn
vị
đo
là
W/m2);
I0
là
cường
độ
của
âm
ở
ngưỡng
nghe
(I0=10-12W/m2).
Logarit không chỉ đơn thuần được ứng dụng để tính độ pH, đo độ chấn động của các trận động đất, đo độ to nhỏ của âm thanh, mà qua các ứng dụng đó logarit nổi bật với vai trò công cụ chuyển các đại lượng có phạm vi quá hẹp hoặc quá rộng về phạm vi dễ kiểm soát hơn.
Chú thích[sửa]
- ↑ Thêm vào bởi thành viên Nguyễn Thế Phúc
Mục lục[sửa]
- Trở về: Trang đầu
Nguồn[sửa]
- Tạp chí KHOA HỌC ĐHSP TPHCM, 2013
- Tác giả: Nguyễn Viết Hiếu (HVCH, Trường Đại học Sư phạm TPHCM)
- Người phản biện khoa học: PGS. TS. Lê Thị Hoài Châu
- (Ngày Tòa soạn nhận được bài: 21-5-2013; ngày phản biện đánh giá: 12-8-2013; ngày chấp nhận đăng: 16-9-2013)





