Giải Nobel Sinh lý và y học 2011
 |
 |
 |
| Bruce A. Beutler | Jules A. Hoffmann | Ralph M. Steinman |
Giải Nobel Sinh lý và y học năm 2011 được trao 1/2 cho nhóm Bruce A. Beutler và Jules A. Hoffmann về những khám phá trong quá trình kích hoạt đáp ứng miễn dịch bẩm sinh và 1/2 dành cho Ralph M. Steinman với sự phát hiện về tế bào hình tua (dendritic cells) và vai trò của chúng trong miễn dịch thích ứng.
Như vậy, giải Nobel năm nay dành cho những nhà khoa học đã đóng góp cho những hiểu biết của nhân loại về hệ thống miễn dịch bằng những khám phá các nguyên lý cơ bản trong quá trình kích hoạt đáp ứng miễn dịch.
Những khoa học gia này đã dành nhiều thời gian tìm kiếm "người gác đền" của những phản ứng miễn dịch mà nhờ đó loài người cũng như động vật có thể bảo vệ mình trước sự tấn công của vi khuẩn và các vi sinh vật gây bệnh.
Bruce Beutler và Jules Hoffmann đã tìm ra thụ thể nhận biết tế bào vi sinh vật ngoại lai và kích hoạt đáp ứng miễn dịch bẩm sinh, cơ chế phòng vệ đầu tiên của hệ thống miễn dịch cơ thể. Ralph Steinman đã phát hiện tế bào hình tua trong hệ thống miễn dịch và khả năng độc đáo của chúng trong việc trình diện kháng nguyên cho hệ thống miễn dịch thích ứng, cơ chế phòng vệ tích cực nhằm loại bỏ sinh vật gây hại ra khỏi cơ thể.
Với những công trình khoa học của ba nhà khoa học đạt giải năm nay, chúng ta đã hiểu được cách thức kích hoạt của các đáp ứng miễn dịch bẩm sinh và thích ứng và từ đó tìm ra nguyên nhân và cơ chế của hàng loạt các bệnh tật. Đóng góp khoa học của họ đã mở ra những con đường mới để phát triển các phương pháp phòng ngừa và liệu pháp chữa trị các bệnh nhiễm khuẩn, bệnh ung thư và các bệnh viêm nhiễm khác.
Mục lục
Hai phòng tuyến chính của hệ miễn dịch[sửa]
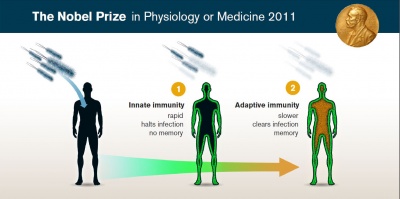
Chúng ta sống trong một thế giới đầy rẫy nguy hiểm. Các vi sinh vật gây bệnh như vi khuẩn, virus, nấm và ký sinh vật luôn đe dọa chúng ta hàng ngày. Tuy nhiên chúng ta được tranh bị một hệ thống phòng thủ hữu hiệu và mạnh mẽ (xem hình). Phòng tuyến đều tiên là miễn dịch bẩm sinh, nơi phá hủy các vi sinh vật đột nhập và kích hoạt phản ứng viêm nhằm ngăn cản sự đột nhập nguy hiểm này. Nếu vi sinh vật có thể vượt qua phòng tuyến này, phản ứng miễn dịch thích ứng liền được khởi động. Những tế bào lympho T và B của phòng tuyến thứ 2 sẽ giải phóng kháng thể và các tế bào gây chết nhằm phá hủy các tế bào đã bị vi sinh vật gây hại đột nhập. Sau khi loại bỏ vật gây hại 1 cách thắng lợi, hệ miễn dịch thích ứng của chúng ta sẽ ghi nhớ kẻ thù và cho phép kích hoạt một phản ứng phòng vệ mạnh mẽ và nhanh nhẹn hơn nếu sinh vật gây hại quay trở lại. Những hệ thống phòng vệ này cho phép bảo vệ hữu hiệu những cũng tiềm tàng những nguy cơ. Nếu một phản ứng miễn dịch quá nhạy hoặc gây đáp ứng miễn dịch chống lại những chất/tế bào của chính cơ thể thì có thể dẫn đến các bệnh liên quan đến viêm nhiễm hay tự miễn.
Những thành viên của hệ thống miễn dịch dần được khám phá trong những năm của thế kỷ 20. Nhờ công sức của hàng loạt những khám phá đã được trao tặng giải Nobel, hiện nay chúng ta đã hiểu biết về cách thức sản xuất kháng thể, cơ chế cho phép tế bào T nhận biết kháng nguyên. Tuy nhiên, phải đến những công trình của Beutler, Hoffmann và Steinman, cơ chế kích hoạt phản ứng miễn dịch bẩm sinh và điều khiển sự giao tiếp giữa miễn dịch bẩm sinh và miễn dịch thích ứng mới được sáng tỏ.
Khám phá về các thụ thể của miễn dịch bẩm sinh[sửa]
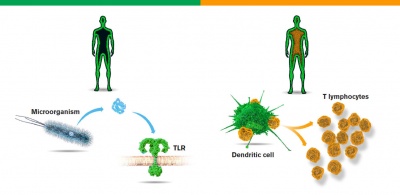
Năm 1996, Jules Hoffmann đã đi tiên phong bằng khám phá cơ chế chống viêm nhiễm của ruồi giấm. Họ đã sử dụng các con ruồi giấm mang các đột biến gene trong đó có Toll, một gene trước đó được Christiane Nüsslein-Volhard (nhận giải Nobel Prize 1995) cho rằng liên quan đến quá trình phát triển của phôi. Khi Hoffmann khiến những con ruồi này bị nhiễm khuẩn hoặc nấm thì ông phát hiện những con ruồi mang đột biến gene Toll bị chết vì chúng không thể khởi động cơ chế phòng vệ hữu hiệu. Ông sau đó đã kết luận sản phẩm của gene Toll có liên quan đến quá trình nhận biết vi sinh vật xâm nhiễm và quá trình kích hoạt Toll là cần thiết để có 1 phản ứng phòng vệ thành công.
Bruce Beutler đã tìm kiếm một thụ thể có thể liên kết với cấu trúc màng nhầy của vi khuẩn, lớp lipopolysaccharide (LPS). Chất này có khả năng gây nên sốc viêm (septic shock), một phản ứng có thể gây chết người do đáp ứng miễn dịch quá mạnh mẽ. Năm 1998, Beutler và cộng sự đã phát hiện rằng có nhóm chuột kháng được LPS do mang 1 đột biến ở gene khá tương đồng với gene Toll của ruồi giấm. Thụ thể giống Toll này sau đó được chứng minh là một thụ thể tiếp nhận LPS. Khi thụ thể liên kết với LPS, các tín hiệu liền được khởi động và gây nên phản ứng viêm. Nếu liều LPS quá ngưỡng, hiện tượng sốc viêm có thể xảy ra. Những phát hiện này đã cho thấy động vật có vú và ruồi giấm đã sử dụng những phân tử tương đồng để kích hoạt phản ứng miễn dịch bẩm sinh khi chúng phát hiện có sinh vật gây hại xâm nhập.
Những khám phá của Hoffmann và Beutler đã khởi đầu cho hàng loạt các nghiên cứu về miễn dịch bẩm sinh. Khoảng một tá các TLR khác nhau đã được phát hiện trên người và trên chuột. Mỗi một loại thụ thể có khả năng nhận biết một nhóm các phân tử phổ biến trong vi sinh vật. Những cá thể mang các đột biến nhất định trên các thụ thể này có khả năng mẫn cảm với các loại xâm nhiễm. Trong khi đó, một số thể đa hình của TLR có thể liên quan đến các bệnh viêm nhiễm mãn tính.
Một dòng tế bào đặc biệt điều khiển đáp ứng miễn dịch thích ứng[sửa]
Năm 1973, Ralph Steinman tìm ra một dòng tế bào mới mà ông gọi là tế bào hình tua. Ông giả định rằng tế bào này có lẽ quan trọng trong hệ thống miễn dịch và tiến hành khảo sát xem tế bào hình tua có thể kích hoạt tế bào T, một nhóm tế bào lympho đóng vai trò chính trong miễn dịch thích ứng và ghi nhớ miễn dịch đối với nhiều loại kháng nguyên khác nhau. Trong các thí nghiệm nuôi cấy mô tế bào, ông đã nhận thấy sự có mặt của tế bào hình tua cho phép phản ứng tế bào T phản ứng linh hoạt với các kháng nguyên. Những phát hiện này thoạt đầu bị hoài nghi nhưng những công trình của Steinman sau đó đã chứng minh các tế bào hình tua có khả năng kích hoạt tế bào T một cách độc đáo.
Những nghiên cứu tiếp theo của Steinman và các nhà khoa học khác đã giải đáp câu hỏi về cơ chế khởi động đáp ứng miễn dịch thích ứng khi bắt gặp các kháng nguyên khác nhau. Những tín hiệu đến từ đáp ứng miễn dịch bẩm sinh và được tế bào hình tua tiếp nhận đã điều khiển quá trình hoạt hóa tế bào T. Điều này cho phép hệ thống miễn dịch phản ứng lại các vi sinh vật xâm nhiễm trong khi tránh được việc tự tấn công các tế bào của bản thân.
Từ nghiên cứu cơ bản đến ứng dụng y khoa[sửa]
Những khám phá được trao giải Nobel năm 2011 đã cung cấp những kiến thức mới trong quá trình kích hoạt và điều khiển hệ thống miễn dịch của con người. Những nghiên cứu này đã cho phép phát triển các phương pháp mới giúp ngăn ngừa và chữa trị các bệnh, ví dụ cải tiến vaccine chống viêm nhiễm và các liệu pháp sử dụng hệ miễn dịch chống hình thành khối u. Những khám phá này cũng giúp chúng ta hiểu thêm về nguyên nhân gây ra các bệnh tự miễn khi hệ miễn dịch tấn công chính bản thân các tế bào của cơ thể.
Tiểu sử[sửa]
Bruce A. Beutler sinh năm 1957 ở Chicago, USA. Ông nhận bằng tiến sĩ y khoa tại University of Chicago năm 1981 và làm việc tại Rockefeller University ở New York và University of Texas ở Dallas, nơi ông đã phát hiện thụ thể LPS. Từ 2000 ông trở thành giáo sự ngành di truyền học và miễn dịch học tại The Scripps Research Institute, La Jolla, USA.
Jules A. Hoffmann sinh tại Echternach, Luxembourg năm 1941. Ông tốt nghiệp the University of Strasbourg ở France, và nhận bằng tiến sĩ vào năm 1969. Sau 1 thời gian làm việc sau tiến sĩ tại University of Marburg, Germany, ông đã trở lại Strasbourg, và dẫn dắt nhóm nghiên cứu của mình từ 1974 đến 2009. Ông cũng đồng thời là viện trưởng của Institute for Molecular Cell Biology ở Strasbourg và trong khoảng thời gian 2007-2008 là chủ tích Viện Hàn Lâm Pháp (French National Academy of Sciences).
Ralph M. Steinman sinh năm 1943 ở Montreal, Canada, nơi ông đã theo học ngành sinh học và hóa học tại McGill University. Sau khi theo học ngành y khoa tại Harvard Medical School ở Boston, MA, USA, ông nhận bằng tiến sĩ Y khoa vào năm 1968. Ông đã về làm việc tại Rockefeller University ở New York từ 1970, và trở thành giáo sư ngành miễn dịch học tại viện này từ 1988, và đồng thời là giám đốc Trung tâm Miễn dịch học và các bệnh miễn dịch. Tin buồn là ông đã mất vào ngày 30 tháng 9 năm 2011, vài ngày trước khi ban tổ chức công bố giải Nobel cho ông.
Các công trình chính[sửa]
- Poltorak A, He X, Smirnova I, Liu MY, Van Huffel C, Du X, Birdwell D, Alejos E, Silva M, Galanos C, Freudenberg M, Ricciardi-Castagnoli P, Layton B, Beutler B. Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: Mutations in Tlr4 gene. Science 1998;282:2085-2088.
- Lemaitre B, Nicolas E, Michaut L, Reichhart JM, Hoffmann JA. The dorsoventral regulatory gene cassette spätzle/Toll/cactus controls the potent antifungal response in drosophila adults. Cell 1996;86:973-983.
- Steinman RM, Cohn ZA. Identification of a novel cell type in peripheral lymphoid organs of mice. J Exp Med 1973;137:1142-1162.
- Steinman RM, Witmer MD. Lymphoid dendritic cells are potent stimulators of the primary mixed leukocyte reaction in mice. Proc Natl Acad Sci USA 1978;75:5132-5136.
- Schuler G, Steinman RM. Murine epidermal Langerhans cells mature into potent immunostimulatory dendritic cells in vitro. J Exp Med 1985;161:526-546.





