Dioxin receptor
Mục lục
Dioxin receptor[sửa]
Dioxin receptor còn có tên khác là Aryl hydrocarbon receptor (AhR hay AHR) là một thành viên trong nhóm protein có cấu trúc cơ bản gồm hai đoạn xoắn nối với nhau bởi phần quai (helix-loop-helix) và đóng vai trò như một yếu tố dịch mã nằm trong tế bào chất (cytosolic transcription factor).
Bình thường, AhR ở trạng thái không hoạt động và được gắn với một số co-chaperone (những protein có vai trò trợ giúp quá trình hình thành dạng cấu trúc của đại phân tử). Khi kết hợp với cơ chất như dioxin, phức hợp gắn giữa AhR với cơ chất được giải phóng, di chuyển vào tế bào chất và kết hợp với yếu tố vận chuyển có tên gọi AhR nuclear translocator (AhR nuclear translocator), tác động đến gene đích làm thay đổi biểu hiện của những gene này. Chính vì cơ chế này mà AhR được xếp vào nhóm các cơ quan thụ cảm nhân.
Các vùng cấu trúc[sửa]
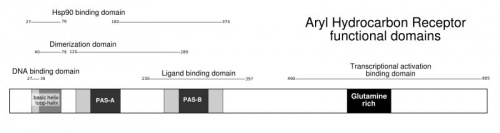
Cũng như hầu hết các thụ quan khác, protein của AhR gồm những vùng cấu trúc đảm nhiệm các chức năng khác nhau để (1) gắn với cơ chất, (2) gắn với protein vận chuyển và DNA. Kiểu xoắn này nằm ở đầu N của phân tử proten(1). AhR bao gồm hai vùng chức năng chính: Vùng cơ bản (basic region) tham gia vào quá trình kết gắn với DNA và vùng quai xoắn tham gia vào quá trình tác động giữa các phân tử protein.
AhR còn mang hai đoạn PAS-A và PAS-B với kích thước khoảng 200-350 axit amin có độ tương đồng cao với protein tìm thấy ở ruồi dấm (Drosophila genes period: Per), single minded (Sim) và trong protein vận chuyển AhR (ARNT)(2).
Vùng PAS-A và PAS-B hỗ trợ quá trình tương tác của AhR với protein mang cấu trúc tương tự PAS (vì vậy chúng thể hiện được vai trò trong quá trình tương tác AhR- ARNT để hình thành phức hợp giữa hai protein này. Vị trí kết hợp với cơ chất (ligand bonding site) nằm trong vùng PAS-B với những thành phần đặc hiệu cho quá trình kết hợp (3,4). Phần cấu tạo còn lại (Q-rich domain) nằm ở phía đầu C đảm nhận chức năng nhận biết và "tranh thủ" các yếu tố tác dụng hiệp đồng(5).
Cơ chất[sửa]
Cơ chất của AhR được phân làm hai nhóm: Nhóm 1 gồm các chất được tổng hợp và nhóm 2 gồm các chất có sẵn trong tự nhiên. Các chất thuộc nhóm 1 bao gồm các halogenated aromatic hydrocarbon như dibenzo-dioxins, dibenzofurans and biphenyls và các polycyclic aromatic hydrocarbons như 3-methylcholanthrene, benzo(a)pyrene, benzanthracenes and benzoflavones (xem thêm). Nhiều nghiên cứu đang được tiến hành để xác định các cơ chất nội sinh (được sinh ra trong cơ thể sinh vật).
Các chất tự nhiên bao gồm các dẫn chất của tryptophan(6), tetrapyrole (7), các dẫn chất của axit arachidonic như lipoxin A4 and prostaglandin G (8), chất biến đổi cấu trúc từ lipoprotein mật độ thấp (LDL)(9) và một số carotinoid trong thực phẩm (10). Các cơ chất có thể tác động theo chiều hướng tăng chức năng của AhR (agonist) hoặc giảm chức năng của AhR (antagonist).
Cơ chế hoạt hóa và tác động đến gene[sửa]
AhR tự do ở trạng thái không hoạt động và gắn với Hsp90 cùng các protein tương tác AhR có tên gọi XAP2 và protein hoạt hóa AhR (ARA9). Phức hợp này giữ cho AhR không bị phân hủy đồng thời xúc tác cho quá trình nhận biết và kết hợp với cơ chất cũng như ngăn cản AhR kết hợp sớm với ARNT khi phức hợp AhR-cơ chất chưa hình thành. XAP2 tương tác với đầu cacboxyl của Hsp90, kết hợp với chuỗi định vị AhR trong nhân (NLS) giúp định hướng khi AhR di chuyển vào nhân tế bào.
Sau khi AhR kết hợp với cơ chất, XAP2 được giải phóng khi tiếp nhận NLS tại vùng quai xoắn làm phức hợp AhR-cơ chất di chuyển vào nhân. Hsp90 giải phóng khi PAS kết hợp với ARNT. Phức hợp đã hoạt hóa AhR/ARNT kết hợp với DNA sau khi "nhận ra" trình tự thích hợp của gene đáp ứng với dioxin. Vị trí nhận biết, kết hợp và phản ứng với phức hợp AhR/ARNT được gọi là yếu tố phản ứng với dioxin (dioxin responsive element, DRE) hay yếu tố phản ứng với chất ngoại lai (xenobiotic- responsive element, XRE) chứa đoạn 5’-GCGTG-3’ nằm trong trình tự 5’-T/GNGCGTGA/CG/CA-3’ tại vùng khởi động của các gene đáp ứng với AhR (AhR responsive genes). Biểu hiện của các gene đích do đáp ứng với dioxin dẫn đến nhiều phản ứng khác nhau trong tế bào. Số lượng và biểu hiện của những gene chịu tác động của dioxin vẫn đang tiếp tục được nghiên cứu.
Vai trò[sửa]
- Tiến hóa và phát triển:
AhR có vai trò trong quá trình phát triển. Từ những động vật không xương sống, AhR đã được biết đến như một thụ quan phụ thuộc cơ chất và đóng vai trò quan trọng trong quá trình phát triển bình thường của động vật (11). Ở ruồi giấm, protein tương tự AhR là yếu tố cần thiết cho quá trình phát triển của các chân và râu (12). Protein tương đồng với yếu tố dịch chuyển Arnt có khả năng xúc tác cho quá trình sao mã. Ở động vật có xương sống, AhR "tiến hóa" và có khả năng kết hợp với cơ chất. Với những động vật có xương sống đang trong giai đoạn phát triển, AhR còn được cho là đóng vai trò trong quá trình phân chia và biệt hóa tế bào (13).
- Đáp ứng thích nghi:
Đáp ứng với các cơ chất được thực hiện khi phức hợp AhR-cơ chất kết hợp với yếu tố đáp ứng dioxin (dioxin response element) trên DNA dẫn đến quá trình sao mã, dịch mã của các gene đích. Nhóm các gene đích bao gồm cả những gene mã hóa các enzyme tham gia vào quá trình biến đổi các chất ngoại lai (xenochemicals, trong đó có dioxin). Nhóm enzym được biết đến sớm nhất là cytochrom 450 (enzym đầu tiên được xác định là Cyp1a1 - mã hóa bởi gene CYP1A1). Các gene khác trong nhóm đã được xác định như CYP1A2, CYP1B1, NQO1, ALHD3A1, UGT1A2 và GSTA1. Sự phong phú của cơ chất và enzym biến đổi cơ chất do Ahr điều phối chứng tỏ vai trò quan trọng của Ahr trong quá trình đáp ứng với các hóa chất bên ngoài...
- Đáp ứng với các chất có tính độc:
Đáp ứng với các chất độc trong đó có dioxin được coi như "phần mở rộng" của đáp ứng thích nghi khi Ahr được hoạt hóa:
(1) đáp ứng thích nghi dẫn đến sự hình thành các enzym trao đổi các chất ngoại lai làm sản sinh các sản phẩm trao đổi có tính độc;
(2) tác động đến những gene đích thông qua bộ pin Ahr (Ahr gene battery) gây biến đổi các quá trình diễn ra trong tế bào và thay đổi chức năng tế bào.
Dioxin receptor knockout mouse[sửa]
Ứng dụng của dioxin receptor knockout[sửa]
Tài liệu tham khảo[sửa]
1. Jones S (2004). An overview of the basic helix-loop-helix proteins. Genome Biol. 5 (6): 226
2. Ema M, Sogawa K, Watanabe N, Chujoh Y, Matsushita N, Gotoh O, Funae Y, Fujii-Kuriyama Y (1992). cDNA cloning and structure of mouse putative Ah receptor. Biochem. Biophys. Res. Commun. 184 (1): 246–53.
3. Coumailleau P, Poellinger L, Gustafsson JA, Whitelaw ML (1995) Definition of a minimal domain of the dioxin receptor that is associated with Hsp90 and maintains wild type ligand binding affinity and specificity. J. Biol. Chem. 270 (42): 25291–300.
4. Goryo K, Suzuki A, Del Carpio CA, Siizaki K, Kuriyama E, Mikami Y, Kinoshita K, Yasumoto K, Rannug A, Miyamoto A, Fujii-Kuriyama Y, Sogawa K (2007) Identification of amino acid residues in the Ah receptor involved in ligand binding". Biochem. Biophys. Res. Commun. 354 (2): 396–402.
5. Kumar MB, Ramadoss P, Reen RK, Vanden Heuvel JP, Perdew GH (2001) The Q-rich subdomain of the human Ah receptor transactivation domain is required for dioxin-mediated transcriptional activity. J. Biol. Chem. 276 (45): 42302–10
6. Adachi J, Mori Y, Matsui S, et al (2001). Indirubin and indigo are potent aryl hydrocarbon receptor ligands present in human urine. J. Biol. Chem. 276 (34): 31475–8
7. Sinal CJ, Bend JR (1997). Aryl hydrocarbon receptor-dependent induction of cyp1a1 by bilirubin in mouse hepatoma hepa 1c1c7 cells. Mol. Pharmacol. 52 (4): 590–9
8. Seidel SD, Winters GM, Rogers WJ, et al (2001). Activation of the Ah receptor signaling pathway by prostaglandins. J. Biochem. Mol. Toxicol. 15 (4): 187–96
9. McMillan BJ, Bradfield CA (2007).The aryl hydrocarbon receptor is activated by modified low-density lipoprotein. Proc. Natl. Acad. Sci. U.S.A. 104 (4): 1412–7.
10. Denison MS, Nagy SR (2003). Activation of the aryl hydrocarbon receptor by structurally diverse exogenous and endogenous chemicals. Annu. Rev. Pharmacol. Toxicol. 43: 309–34.
Xem thêm[sửa]
- Tìm hiểu về dioxin
- Herbicides in war: Current status and future doubt
- Vai trò của dioxin receptor trong điều hòa ảnh hưởng của estradiol và genistein đến quá trình phát triển xương
Bài liên quan
Liên kết đến đây
- Tìm hiểu về dioxin
- Dioxin receptor knockout
- Vai trò của dioxin receptor trong điều hòa ảnh hưởng của estradiol và genistein đến quá trình phát triển xương
- Cơ chế hình thành khí khổng
- Effects of resveratrol and estradiol on expression of cardiac hypertrophy markers in ovariectomized mice carrying knockout aryl hydrocarbon receptor.
- Estradiol and genistein exaggerate cardiac hypertrophy in ovariectomized AhR knockout mice with different effects on gene expression of hypertrophy markers.