Lecture:Sinh học Đại cương MIT 7.013/Chapter 2
Sự sống và hoá học
Mục lục
Những phân tử nhỏ[sửa]
Sao Hỏa ngày nay là một nơi lạnh lẽo và khô khốc, không thích hợp cho sự sống mà chúng ta biết, nhưng 3 tỉ năm trước nó đã từng là một nơi ấm và ẩm hơn. Một vệ tinh thăm dò trên quỹ đạo trái đất gần đây đã chụp được một lòng hồ khô khổng lồ, kích thước bằng bang New Mexico và Texas gộp lại trên bề mặt sao Hoả. Một vệ tinh do thám khác phát hiện thấy bằng chứng của nước nằm kẹt dưới bề mặt băng của vùng cực sao Hoả. Những khám phá này của các nhà địa chất đã khơi dậy sự quan tâm của các nhà sinh học vì nơi nào có nước là nơi đó có sự sống. Có lý do vững chắc để tin rằng sự sống mà chúng ta biết không thể tồn tại mà không có nước.
Động vật và thực vật sinh sống trên bề mặt trái đất phải phát triển những phương thức phức tạp để giữ nước, chiếm 70% trọng lượng cơ thể của chúng. Các thủy sinh vật sống trong nước không cần các cơ chế giữ nước này, vì vậy các nhà sinh học kết luận rằng những cơ thể sống đầu tiên có nguồn gốc từ môi trường nước. Môi trường nước này không nhất thiết phải là sông, hồ hay đại dương mà chúng ta thường nghĩ. Các cơ thể sống đã được phát hiện ở những suối nước nóng ở nhiệt độ trên điểm sôi thông thường của nước, ở một hồ nằm dưới lớp băng của lục địa Antarctic Nam Cực, hoặc ở trong nước kẹt dưới bề mặt trái đất 2 dặm, hoặc trong vùng nước trên mặt nước biển 3 dặm, trong môi trường nước với độ acid hoặc độ mặn cực cao, hoặc thậm chí trong nước làm lạnh bộ phận bên trong của lò phản ứng hạt nhân.
Với 20 nghìn tỉ thiên hà trong vũ trụ, mỗi thiên hà gồm 100 tỉ ngôi sao, vũ trụ có rất nhiều hành tinh, và nếu hệ mặt trời của chúng ta là điển hình của một thiên hà thì một vài trong số các hành tinh này có nước cần thiết cho sự sống. Khi các nhà sinh vật suy tư về việc sự sống bắt đầu như thế nào từ những vật chất không sống thì sự chú ý của họ không chỉ vào sự hiện diện của nước mà còn những gì hòa tan trong đó.
Một khám phá lớn của sinh học là những cơ thể sống được cấu tạo từ cùng những loại nguyên tố tạo nên phần không sống khổng lồ của vũ trụ. Quan niệm mang tính cơ học này - rằng sự sống có nền tảng hóa học và tuân theo các định luật Hoá-Lý chung - chỉ mới có gần đây trong lịch sử loài người. Khái niệm một "lực sự sống" là nguyên nhân tạo nên sự sống, khác với những lực khác trong Vật lý và Hóa học là một quan niệm phổ biến trong văn hóa Phương Tây cho đến thế kỷ 19, và nhiều người vẫn cho rằng có một lực như vậy. Tuy nhiên hầu hết các nhà khoa học đều tin tưởng tuyệt đối vào quan niệm cơ học về sự sống, và nó là nền móng cho Y học và Nông nghiệp.
Trước khi mô tả các nguyên tố hóa học được sắp xếp như thế nào trong sinh vật sống, chúng ta sẽ tìm hiểu một số khái niệm Hóa học cơ bản. Trước tiên chúng ta sẽ nói về các thành phần của vật chất: nguyên tử. Chúng ta sẽ tìm hiểu về các loại nguyên tử, đặc tính của chúng và khả năng chúng có thể kết hợp với các nguyên tử khác. Sau đó chúng ta sẽ xem xét vật chất biến đổi như thế nào. Ngoài những thay đổi vè trạng thái (từ rắn sang lỏng sang khí), các chất còn thay đổi, biến đổi về cả thành phần lẫn tính chất đặc trưng. Tiếp đó chúng ta sẽ mô tả cấu trúc và tính chất của nước và mối quan hệ của nó với các axít và bazơ. Chúng ta sẽ kết thúc chương bằng việc xem xét các nhóm nguyên tử đặc trưng đóng góp những tính chất đặc thù cho những phân tử lớn hơn mà chúng là một thành phần, và đó sẽ là chủ đề của chương 3.
Một thung lũng Lớn hơn trên bề mặt sao Hoả: Bức ảnh màu nhân tạo này cho thấy màu xanh lục là phần đáy khô còn lại của một cái hồ khổng lồ đã từng tồn tại trên sao Hoả. Cũng như sông Colorado tạo nên Thung lũng lớn, các dòng nước từ hồ này có lẽ đã tạo nên cái thung lũng sâu hàng dặm mà trên ảnh chính là đường xanh lục mỏng nằm ngay ở phía Bắc của lòng hồ
Nước và nguồn gốc hoá học của sự sống[sửa]
Các nhà thiên văn học tin rằng hệ mặt trời của chúng ta bắt đầu hình thành quãng 4,6 tỉ năm về trước khi một ngôi sao nổ tung sau đó suy sụp tạo nên mặt trời, và khoảng 500 vật thể gọi là các tiểu hành tinh va chạm với nhau để tạo nên các hành tinh bên trong, trong đó có trái đất. Những dấu hiệu hóa học đầu tiên chỉ ra rằng sự tồn tại của sự sống cách đây 4 tỉ năm. Như vậy mất đến 600 triệu năm, mà trong khung thời gian địa lý gọi là Hadean (xuất phát từ Hades - có tính địa phủ - không có sự sống) để các điều kiện hóa học trên trái đất trở nên vừa đúng thích hợp cho sự sống. Một điều kiện quan trọng trong số này là sự tồn tại của nước.
Trái đất cổ xưa có lẽ có rất nhiều nước trong không khí. Nhưng do hành tinh mới hình thành rất nóng nên nước này bay hơi và thoát vào không gian. Khi Trái đất nguội đi nước có thể lưu lại trên bề mặt của nó, nhưng nước này từ đâu mà ra? Một quan điểm hiện nay cho rằng các sao chổi -những đám bụi và băng thiếu cấu trúc quay quanh quỹ đạo mặt trời từ khi các hành tinh được tạo ra - liên tục va vào Trái đất và mang không chỉ nước mà còn các thành phần hóa học khác của sự sống, ví dụ Nitơ. Khi trái đất nguội, các hóa chất từ các tảng đá hòa tan vào nước và các phản ứng hóa học đơn giản diễn ra. Một số các phản ứng này lẽ ra có khả năng tạo nên sự sống, nhưng những tác động bởi những sao chổi khổng lồ và những thiên thạch sẽ tạo ra đủ năng lượng để làm sôi các đại dương đang hình thành, vì vậy sẽ phá hủy bất kỳ sự sống đầu tiên nào. Những tác động quy mô lớn này dần đi vào ổn định, và sự sống chiếm lĩnh khoảng 3,8 đến 4 triệu năm trước đây. Thời kỳ Hadean tiền sự sống chấm dứt (Hình 2.1) Thời kỳ Archean (tiền Cambrian) bắt đầu, và từ đó đến nay sự sống tồn tại trên trái đất.
Trong chương 3 chúng ta sẽ quay lại câu hỏi làm thế nào sự sống đầu tiên có thể xuất hiện từ những chất vô tri vô giác. Nhưng trước khi làm điều đó chúng ta cần hiểu hóa học của sự sống đòi hỏi những gì. Giống như phần còn lại của thế giới vật chất, các vật sống được tạo nên từ nguyên tử và phân tử.
Hình 2.1 Trục thời gian địa chất. Kỷ Hadean bao gồm thời gian từ lúc hình thành trái đất (khoảng 4,6 tỉ năm trước) cho đến khi sự sống đầu tiên xuất hiện (khoảng 3,8 tỉ năm trước). Trong giai đoạn kỷ Hadean các điều kiện hóa học thay đổi tạo điều kiện thuận lợi cho sự sống, và sự sống có thể chiếm lĩnh trái đất một khi các trận mưa sao chổi và thiên thạch chấm dứt
Nguyên tử : Thành phần của vật chất[sửa]
Hơn một nghìn tỉ nguyên tử có thể đặt đủ vào dấu chấm ở cuối câu này. Mỗi nguyên tử được cấu tạo từ một nhân và chuyển động xung quanh nó là một hoặc một số electron (Hình 2.2). Nhân chứa một hoặc một số proton và một hoặc một số neutron. Nguyên tử và các cấu tử của nó có thể tích và khối lượng, hai tính chất của mọi vật chất. Khối lượng đo lượng vật hiện diện; khối lượng càng lớn thì lượng vật chất càng lớn.
Khối
lượng
của
proton
có
chức
năng
là
một
đơn
vị
đo
chuẩn:
đơn
vị
khối
lượng
nguyên
tử
hay
dalton
(đặt
tên
theo
nhà
hóa
học
người
Anh
John
Dalton).
Một
proton
hay
neutron
có
khối
lượng
khoảng
1
dalton
(Da),
tương
đương
với
1,7.10-24
gram
(0,0000000000000000000000017g).
Khối
lượng
một
electron
khoảng
9.10-28
g
(0,0005
Da).
Vì
khối
lượng
của
một
electron
không
đáng
kể
so
với
khối
lượng
của
một
proton
hay
một
neutron,
người
ta
thường
bỏ
qua
sự
đóng
góp
của
electron
vào
khối
lượng
nguyên
tử
khi
tính
toán.
Tuy
nhiên
chính
electron
mới
quyết
định
cách
các
nguyên
tử
tương
tác
với
nhau
trong
các
phản
ứng
hóa
học,
và
chúng
ta
sẽ
bàn
nhiều
về
vấn
đề
này
sau
trong
chương
này.
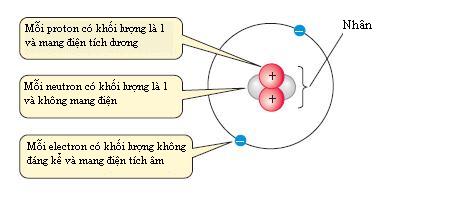
Hình 2.2: Ngyên tử helium
Mỗi proton tích điện dương, được định nghĩa là +1 đơn vị tích điện. Một electron có điện tích âm bằng và trái dấu với điện tích của proton; vì vậy điện tích của electron là -1 đơn vị. Neutron, đúng như tên nó phản ảnh, không tích điện vì vậy điện tích của nó là 0 đơn vị. Các điện tích trái dấu (+/-) thì hút nhau còn các điện tích cùng dấu (+/+ hay -/-) thì đẩy nhau. Các nguyên tử đều trung hòa về điện: Số lượng proton trong một nguyên tử bằng với số lượng electron.
Một nguyên tố được cấu tạo nên chỉ từ một loại nguyên tử[sửa]
Một nguyên tố là một chất tinh khiết chỉ chứa một loại nguyên tử. Nguyên tố Hydrô chỉ chứa một loại nguyên tử hydrô; nguyên tố sắt chỉ chứa các nguyên tử sắt. Nguyên tử của mỗi nguyên tố có những đặc tính hoặc tính chất nhất định phân biệt chúng với các nguyên tử của nguyên tố khác. Hơn 100 nguyên tố tìm thấy trong vũ trụ được sắp xếp trong bảng tuần hoàn (Hình 2.3). Các nguyên tố này được tìm thấy với trữ lượng khác nhau. Các ngôi sao có rất nhiều Hydrô và Hêli. Đất của trái đất và ở những hành tinh gần đó chứa gần một nửa là Oxy, 28% silicon, 8% nhôm, 2-5% cho mỗi một nguyên tố Natri, Magiê, Kali, Canxi và sắt và chưa một lượng ít hơn nhiều các nguyên tố khác.
Khoảng
98%
trọng
lượng
của
mọi
cơ
thể
sống
(vi
khuẩn,
củ
cải
hay
con
người)
đều
được
tạo
nên
từ
chỉ
sáu
nguyên
tố:
Carbon,
hydro,
Nitơ,
oxy,
phốt
pho
và
lưu
huỳnh.
Hóa
tính
của
sáu
nguyên
tố
này
sẽ
là
mối
quan
tâm
hàng
đầu
của
chúng
ta
ở
đây,
nhưng
các
nguyên
tố
khác
không
phải
không
quan
trọng.
Ví
dụ
Na
và
K
quan
trọng
đối
với
chức
năng
thần
kinh;
Ca
có
thể
hoạt
động
như
một
tín
hiệu
sinh
học;
iod
là
thành
phần
của
một
loại
hormone
quan
trọng;
và
cây
cần
Magiê
như
một
phần
của
lục
sắc
tố
(chlorophyll)
và
molybdenum
để
chuyển
hóa
N
vào
các
hợp
chất
sinh
học
có
ích.
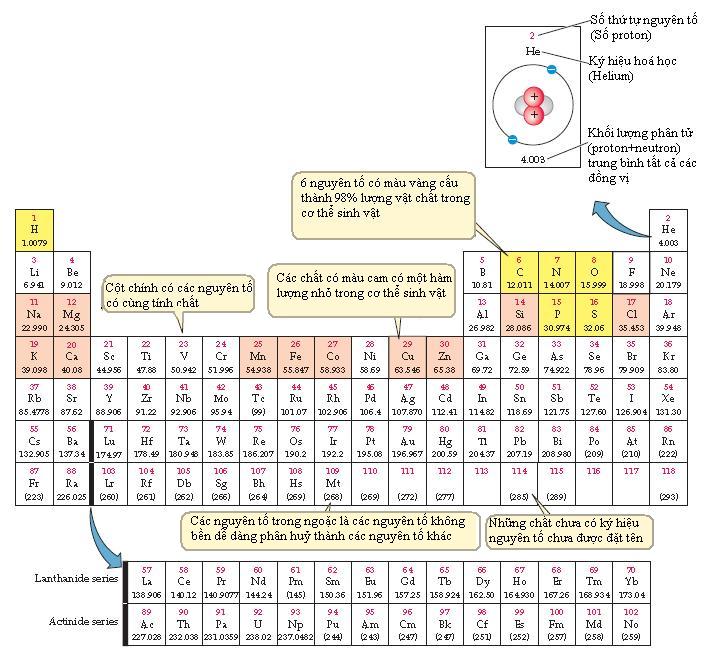
Hình 2.3: Hệ thống tuần hoàn các nguyên tố hóa học các nguyên tố được xắp xếp theo đặt tính vật lý và hóa học. 1-92 là các nguyên tố tự nhiên, các nguyên tố từ 93 trở về sau được tạo ra trong phòng thí nghiệm
Số lượng proton quyết định loại nguyên tố[sửa]
Một nguyên tố được phân biệt với một nguyên tố khác bằng số lượng proton ở mỗi nguyên tử của nó. Con số này không bao giờ thay đổi và được gọi là số nguyên tử. Một nguyên tử Heli có 2 proton và một nguyên tử oxy có 8 proton; như vậy số nguyên tử của hai nguyên tố này lần lượt là 2 và 8.
Cùng với một số lượng proton xác định, mỗi nguyên tố ngoại trừ Hydro có một hoặc một vài neutron trong nhân của nó. Số khối của một nguyên tử là tổng số proton và neutron trong nhân của nó. Nhân của Heli chứa 2 proton và 2 neutron; oxy có 8 proton và 8 neutron. Vì vậy Heli có số khối là 4 và oxy có số khối là 17. Số khối có thể coi là trọng lượng của nguyên tử tính theo đơn vị Dalton.
Mỗi nguyên tố có ký hiệu hóa học gồm một hoặc hai chữ cái riêng. Ví dụ H là ký hiệu của Hydrô, He là ký hiệu của Heli và O là ký hiệu của Oxy. Một số ký hiệu có nguồn gốc từ các ngôn ngữ khác: Fe (từ tiếng Latin ferrum) ký hiệu cho sắt, Na (Latin là natrium) ký hiệu cho Natri, và W (Tiếng Đức, Wolfram) ký hiệu cho Von-fram.
Trong các sách, ngay trước ký hiệu cho một nguyên tố, số nguyên tử được viết ở phía dưới bên trái và số khối được viết ở phía trên bên trái. Vì vậy hydro, carbon và oxy được viết lần lượt như sau H11, C126, O168,
Các đồng vị khác nhau về số neutron[sửa]
Các nguyên tố có thể có nhiều hơn một dạng nguyên tử. Các đồng vị của cùng một nguyên tố đều có cùng một số proton xác định nhưng khác nhau về số neutron trong nhân nguyên tử.
Trong tự nhiên nhiều nguyên tố tồn tại ở nhiều dạng đồng vị. Các đồng vị của Hydro ở Hình 2.4 có các tên riêng, nhưng đồng vị của hầu hết các nguyên tố không có tên riêng. Ví dụ đồng vị trong tự nhiên của Carbon là 12C, 13Cvà 14C(được đề cập dưới tên gọi Carbon 12, Carbon 13 và Carbon 14). Hầu hết nguyên tử Carbon đều là 12C, khoảng 1,1% là 13C và chỉ một phần rất nhỏ là 14C. Một khối lượng nguyên tử của một nguyên tố, tức trọng lượng nguyên tử * là trung bình số khối của một mẫu đại diện các nguyên tử của nguyên tố đó, với tất cả các đồng vị theo tỉ lệ của chúng thường gặp. Do đó trọng lượng nguyên tử của Carbon được tính là 12,011.
Một số đồng vị, gọi là đồng vị phóng xạ, không bền và tự phát ra năng lượng dưới dạng các phóng xạ α (alpha), β (beta) hay γ (gamma) từ nhân nguyên tử. Sự phân rã phóng xạ như vậy biến nguyên tử ban đầu thành một nguyên tử khác, thường là một nguyên tố khác. Ví vụ carbon-14 mất một hạt β (thật ra là một electron) để tạo nên 14N. Các nhà Sinh vật và Vật lý có thể kết hợp các đồng vị phóng xạ vào các nguyên tử và sử dụng phóng xạ phát ra như một dấu hiệu để xác định vị trí của những phân tử này hoặc xác định những thay đổi mà phân tử này đang trải qua trong cơ thể (Hình 2.5). Ba đồng vị phóng xạ được sử dụng phổ biến theo cách này là 1H (tritium), 14C (carbon-14) và 32P (phốtpho 32). Ngoài những ứng dụng này các đồng vị phóng xạ còn được sử dụng để định tuổi các hóa thạch (xem chương 22).
Mặc dù đồng vị phóng xạ có ích cho các thí nghiệm và trong Y học, chỉ một liều thấp phóng xạ của chúng có khả năng hủy hoại tế bào và các phân tử. Chúng ta biết rất rõ các tác dụng tàn phá của các vũ khí hạt nhân cũng như những lo ngại về sự hủy hoại các sinh vật từ các đồng vị sử dụng trong nhà máy điện hạt nhân. Trong Y học, phóng xạ γ từ 60Co (Cobalt 60) được sử dụng để phá hủy hoặc giết các tế bào ung thư.
Trong khi bàn về các đồng vị và tính phóng xạ, chúng ta đã tập trung vào hạt nhân nguyên tử, nhưng nhân không đóng vai trò trực tiếp trong khả năng kết hợp của nguyên tử với các nguyên tử khác. Khả năng này được quyết định bởi số lượng và sự phân bố của các electron. Trong các phần tiếp theo chúng ta sẽ mô tả một ố tính chất và cách thức hoạt động hóa học của electrons.
Cách thức hoạt động của electron quyết định liên kết hóa học[sửa]
Khi xem xét các nguyên tử, các nhà sinh học chủ yếu quan tâm đến electrons vì cách thức hoạt động của electron giải thích những biến đổi hóa học xảy ra như thế nào trong tế bào sống. Những biến đổi này, gọi là phản ứng hóa học hay đơn giản là phản ứng, là những thay đổi trong thành phần của chất. Số electron đặc trưng trong mỗi nguyên tử của một nguyên tố quyêt định cách các nguyên tử của nó phản ứng với các nguyên tử khác. Mọi phản ứng hóa học liên quan đến sự thay đổi về mối quan hệ giữa các electron với nhau.
Vị trí của một electron trong một nguyên tử tại một thời điểm bât kỳ là không thể xác định. Chúng ta chỉ có thể mô tả một khoảng không gian trong nguyên tử trong đó electron có khả năng có mặt. Vùng không gian nơi electron được tìm thấy ít nhất 90% số lần chính là orbital của electron (Hình 2.6). Trong một nguyên tử, một orbital nhất định có thể được chiếm lĩnh bởi nhiều nhất là hai electron. Vì vậy bất kỳ nguyên tử nào lớn hơn Heli (số nguyên tử là 2) phải có các electron trong hai orbital trở lên. Như hình 2.6 cho thấy, các orbital khác nhau có các dạng & hướng đặc trưng trong không gian. Các orbital lại tạo nên một loạt các lớp vỏ điện tử, hay mức năng lượng quanh hạt nhân (Hình 2.7). > Lớp vỏ điện tử trong cùng chỉ có một orbital, gọi là orbital s. Hydro (1H) có một electron trong lớp vỏ đầu tiên; Heli (2He) có hai. Tất cả nguyên tố khác có hai electron ở lớp vỏ thứ nhất cũng như các electron trong các lớp vỏ khác.
> Lớp vỏ thứ hai được tạo nên bởi bốn orbital (một orbital s và ba orbital p) và vì vậy có thể giữ tới tám electron.
Các orbital s chứa đầy electron trước và các electron của chúng có mức năng lượng thấp nhất. Các vỏ tiếp theo có số các orbital khác nhau, nhưng lớp vỏ ngoài cùng nhất thường chỉ chứa tám electron. Trong bất kỳ nguyên tử nào, lớp vỏ điện tử ngoài cùng quyết định cách các nguyên tử kết hợp với các nguyên tử khác - tức hóa tính của nguyên tử. Khi một lớp vỏ ngoài cùng tạo bởi bốn orbital chứa tám electron sẽ không có electron nào không cặp đôi (xem Hình 2.7). Một nguyên tử như vậy bền vững và sẽ không phản ứng với các nguyên tử khác. Các ví dụ về các nguyên tố bền vững là Heli, Neon và Argon.
Các nguyên tử có hoạt tính tìm cách đạt tới trạng thái bền vững không có electron không cặp đôi ở lớp vỏ ngoài cùng. Chúng đạt được sự bền vững này bằng cách chia xẻ electron với các nguyên tử khác, hoặc bằng cách cho hoặc nhận một hoặc một vài electron. Trong cả hai trường hợp các nguyên tử được liên kết với nhau. Những liên kết như vậy tạo ra tổ hợp bền vững giữa các nguyên tử gọi là phân tử.
Một phân tử là hai hoặc nhiều nguyên tử liên kết với nhau bằng liên kết hóa học. Xu hướng đạt được tám điện tử ở lớp vỏ ngoài cùng của các nguyên tử trong các phân tử bền vững được biết dưới tên gọi quy tắc "bát tử". Nhiều nguyên tử có ý nghĩa sinh học, ví dụ carbon (C) và nitơ (N) tuân theo quy tắc bát tử. Tuy nhiên một số nguyên tử có ý nghĩa sinh học không tuân theo quy tắc này. Hyđro (H) là một ví dụ dễ thấy nhất, đạt tới trạng thái cân bằng khi chỉ có hai electron chiếm lớp vỏ duy nhất của nó.
Các liên kết hoá học : Sự kết nối các nguyên tử[sửa]
Liên
kết
hoá
học
là
một
dạng
lực
hấp
dẫn
kết
nối
hai
nguyên
tử
để
hình
thành
một
phân
tử.
Có
một
số
loại
liên
kết
hoá
học
(bảng
2.1),
ở
phần
này
chúng
ta
sẽ
tìm
hiểu
về
liên
kết
hoá
học
cộng
hoá
trị
là
kết
quả
của
việc
dùng
chung
các
điện
tử..
Sau
đó
chúng
ta
sẽ
xem
xét
các
loại
tương
tác
khác
như:
liên
kết
Hyđro,
là
một
loại
liên
kết
yếu
nhưng
vô
cùng
quan
trọng
trong
sinh
học.
Cuối
cùng
chúng
ta
xét
đến
liên
kết
ion.
được
hình
thành
khi
nguyên
tử
mất
đi
hoặc
nhận
thêm
điện
tử.
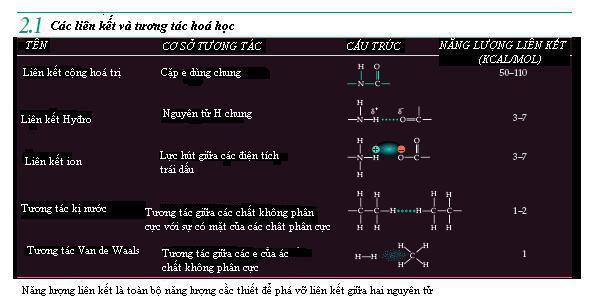
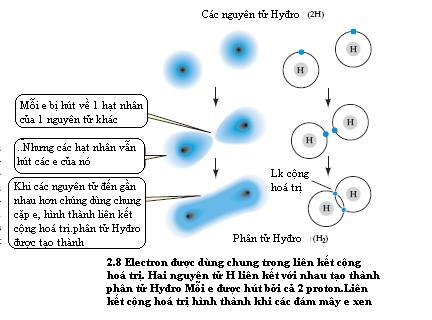
Các liên kết cộng hoá trị : dựa trên các cặp điện tử dùng chung Khi hai nguyên tử đạt được số điện tử ổn định ở lớp vỏ ngoài của chúng bằng cáchđưa ra một hay nhiều cặp điện tử dùng chung., liên kết cộng hoá trị được hình thành. Xem xét hai nguyên tử Hyđro ở gần nhau, mỗi nguyên tử có một điện tử độc thân ở ngoài vỏ. Mỗi hạt nhân mang điện tích dương hút các điện tử độc thân của các ngyên tử khác nhưng lực hút này được cân bằng bởi lực hút của hạt nhân nguyên tử của chính điện tử đó.Do đó hai điện tử độc thân đã được hai ngyên tử dùng chung, lấp đầy lớp vỏ ngoài của cả hai nguyên tử đó.Như vậy chúng được nối với nhau bằng liên kết cộng hoá trị và một phân tử khí Hyđro (H2)được tạo thành.
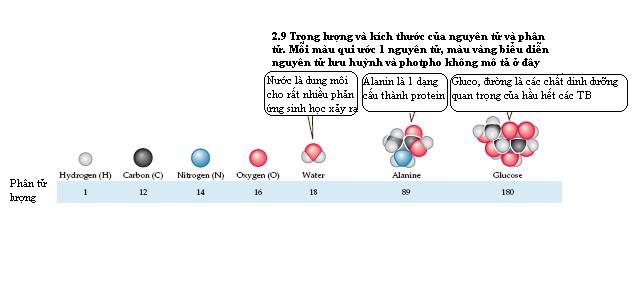
Một phân tử được tạo thành từ hơn một loại nguyên tử đựoc gọi là một hợp chất. Một công thức phân tử sử dụng các kí hiệu hoá học để biểu diễn các nguyên tử khác nhau trong một hợp chất , các chỉ số viết phía dưới chỉ số nguyên tử mỗi loại trong phân tử. Ví dụ công thức của đường mía saccarozo là C12H22O11. Mỗi hợp chất có phân tử lượng (khối lượng phân tử) là tổng nguyên tử lượng của tất cả các nguyên tử trong phân tử.Nhìn vào bảng tuần hoàn bạn có thể tính được khối lượng phân tử của đường mía là 342. Khối lương phân tử thường liên quan đến kích thước phân tử.(hình 2.9)
Một nguyên tử cacbon có 6 điện tử ở lớp vỏ; 2 điện tử lấp đầy lớp vỏ bên trong và 4 điện tử ở lớp vỏ ngoài.Lớp vỏ ngoài này có thể chứa được 8 điện tử, Cacbon có thể dùng chung điện tử với 4 nguyên tử khác …. Nó có thể hình thành 4 liên kết cộng hoá trị. Khi một nguyên tử cacbon phản ứng với 4 nguyênt ử Hyđro, phân tử Metan được hình thành (Hình 2.10a). Nhờ có các điện tử dùng chung lớp vỏ ngoài của nguyên tử cacbon trong phân tử Metan được lấp đầy với 8 điện tử, và lớp vỏ ngoài của mổi nguyênt ử Hyđro cũng được lấp đầy. 4 liên kết cộng hoá trị - mỗi liên kết chứa 1 cặp điện tử dùng chung , cùng tạo nên phân tử Metan. Bảng 2.2 chỉ ra các liên kết công hoá trị của một số nguyên tố có ý nghĩa sinh học quan trọng.
Định hướng liên kết cộng hóa trị
Các liên kết cộng hoá trị là các liên kết mạnh. Năng lượng nhiệt mà các phân tử sinh học thông thường có ở nhiệt độ cơ thể nhỏ hơn 1% năng lượng cần thiết để phá vỡ các liên kết cộng hoá trị. Vì vậy với hầu hết các phân tử sinh học,liên kết cộng hoá trị làm cho chúng trở nên khá bền vững. Điều này có nghĩa là cấu trúc ba chiều và không gian chúng chiếm giữ khá ổn định. Một đặc tính thứ hai của liên kết cộng hoá trị : đối với một cặp nguyên tử, liên kết cộng hoá trị giữa chúng luôn giống nhau về độ dài, góc, hướng liên kết bất chấp chúng nằm trong phân tử lớn hay nhỏ. Ví dụ như 4 orbitals được lấp đầy quanh hạt nhân Cacbon của phân tử Metan, bản thân chúng đóng góp các không gian để các nguyên tử Hyđro liên kết được định hướng vào các góc của 1 khối tứ diện đều với Cacbon là tâm của khối tứ diện đó. Cấu trúc 3 chiều của Cacbon và Hyđro cũng tương tự như vậy trong đại phân tử Protein phức tạp. Đặc điểm này của liên kết cộng hoá trị giúp chúng ta có thể dự đoán được các cấu trúc sinh học.
Mặc dù sự định hướng của các orbital và hình dạng của các phân tử khác nhau phụ thuộc vào từng loại nguyên tử có liên quan và chúng liên kết với nhau như thế nào, cũng cần phải nhớ rằng tất cả các phân tử đều chiếm giữ không gian và có cấu trúc 3 chiều. Hình dạng của phân tử góp phần tạo nên chức năng sinh học của chúng, chúng ta sẽ nghiên cứu ở chương 3.
2.2
Khả
năng
tạo
liên
kết
cộng
hoá
trị
của
một
số
nguyên
tố
sinh
học
quan
trọng
Ngyên tố: Số liên kết cộng hoá trị thông thường
Hyđro (H) 1
Oxy (O) 2
Lưu huỳnh (S) 2
Nitơ (N) 3
Cacbon (C) 4
Photpho(P) 5
Các
loại
liên
kết
cộng
hoá
trị:
Một
liên
kết
cộng
hoá
trị
được
biểu
diễn
bằng
1
gạch
nối
giữa
hai
nguyên
tử
liên
kết
với
nhau.:
-
Liên
kết
đơn
chứa
một
cặp
điện
tử
dùng
chung
(
ví
dụ
H
-
H,
C
-
C).
-
Liên
kết
đôi
chứa
4
(2
cặp)
điên
tử
dùng
chung
(C
=
C).
Các
liên
kết
ba
(6
điện
tử
dùng
chung)
rất
hiếm
nhưng
chúng
ta
có
thể
gặp
ở
liên
kết
của
phân
tử
khí
Nitơ
(N≡N
)
là
thành
phần
chính
của
không
khí
.
Các
điện
tử
dùng
chung
không
cân
bằng
Nếu
hai
nguyên
tử
của
một
nguyên
tố
liên
kết
cộng
hoá
trị
với
nhau
chúng
cùng
chia
sẻ
cặp
điện
tử
ở
trạng
thái
cân
bằng.Tuy
nhiên
khi
hai
nguyên
tử
là
hai
nguyên
tố
khác
nhau
không
còn
sự
cân
bằng
nữa.
Một
hạt
nhân
có
thể
tác
động
lực
hút
tĩnh
điện
lớn
hơn
vào
cặp
điện
tử
làm
chocặp
diệ
tử
này
có
xu
hướng
gần
hơn
với
nguyên
tử
chứa
hạt
nhân
đó.
Lực
hút
của
nguyên
tử
tác
động
lên
các
điên
tử
được
biểu
hiện
bằng
độ
âm
điện
cúa
nguyên
tử
đó.
Nó
phụ
thuộc
vào
số
điện
tích
dương
của
hạt
nhân
(
trong
nhân
có
càng
nhiều
proton
thì
điện
tích
dương
càng
lớn
và
hút
điện
tử
càng
mạnh
)
và
khoảng
cách
từ
hạt
nhân
đến
các
điện
tử
(khoảng
cách
càng
gấn
ái
lực
càng
lớn)
Hai
nguyên
tử
càng
gần
nhau
về
độ
âm
điện
cặp
điện
tử
dùng
chung
càng
ở
dễ
ở
vị
trí
cân
bằng.
Bảng
2.3
chỉ
ra
độ
âm
điện
của
một
số
nguyên
tố
quan
trọng
trong
sinh
học.Từ
bảng
đó
ta
thấy
hai
nguyên
t
ử
Oxy
đều
có
độ
âm
điện
là
3.5
sẽ
chia
sẻ
cặp
điện
tử
cân
bằng,
hình
thành
liên
kết
cộng
hoá
trị
không
phân
cực.
Tương
tự
như
vậy
với
hai
nguyên
tử
Hyđro
(2.1)
2.3 Độ âm điện của một số nguyên tố sinh học
Nguyên tố : Độ âm điện
Oxy (O) 3.5
Clo (Cl) 3.1
Nitơ (N) 3.0
Cacbon (C) 2.5
Photpho (P) 2.1
Hyđro (H) 2.1
Natri (Na) 0.9
Kali (K) 0.8
Nhưng
khi
Hyđro
liên
kết
với
Oxy
để
hình
thành
nước
các
điện
tử
ở
vị
trí
không
cân
bằng :
chúng
có
xu
hướng
gần
với
Oxy
hơn
vì
Oxy
có
độ
âm
địên
lớn
hơn.
Ở
đay
liên
kết
cộng
hoá
trị
phân
cực
được
tạo
thành.(hình
2.11).
Vì
các
điện
tử
được
chia
sẻ
không
đều
,
nên
Oxy
trong
liên
kết
Hyđro
–
Oxy
gần
như
mang
điện
tích
âm
(
kí
hiệu
là
δ-
,
đọc
là
“delta
trừ”
nghĩa
là
đơn
vị
điện
tích
từng
phần)
Hyđro
coi
như
mang
điện
tích
dương
(δ+).Liên
kết
này
phân
cực
các
điệ
tích
trái
dấu
tập
trng
ở
hai
đầu
(2
cực)
của
liên
kết.
điệ
tích
từng
phần
tạo
ra
từ
liên
kết
cộng
hoá
trị
phân
cực
làm
cho
phân
tử
phân
cực
hay
xuất
hiện
cac
vùng
phân
cực
trong
các
đại
phân
tử.Liên
kết
phân
cực
gây
ảnh
hưởng
lớn
đến
sự
tương
tác
giữa
các
phân
tử
chứa
chúng.
Liên
kết
Hyđro
có
thể
hình
thành
giữa
các
nguyên
tử
trong
liên
kết
cộng
hoá
trị
có
cực.
Trong
nước
lỏng,
nguyên
tử
Oxy
mang
điện
tích
âm
(δ-)
của
1
phân
tử
nước
sẽ
hút
các
nguyên
tử
Hyđro
mang
điện
tích
dương
(δ+)
của
phân
tử
nước
khác
(
do
các
điện
tích
âm
hút
các
điện
tích
dương).
Liên
kết
như
vậy
được
gọi
là
liên
kết
Hyđro.
Liên
kết
Hyđro
không
chỉ
tồn
tại
giữa
các
phân
tử
nước.
Chúng
có
thể
hình
thành
giữa
một
nguyên
tử
có
độ
âm
điện
lớn
và
một
nguyên
tử
Hyđro
liên
kết
cộng
hoá
trị
với
một
nguyên
tử
có
độ
âm
điện
lớn
khác(hình
2.12).
Liên
kết
Hyđro
là
một
liến
kết
yếu
nó
chỉ
bằng
1/10
(10%)
của
liên
kết
cộng
hoá
trị
giữa
1
nguyên
tử
Hyđro
và
1
nguyên
tử
Oxy.(xem
bảng
2.1).
Tuy
nhiên
khi
nhiều
liên
kết
Hyđro
được
hình
thành
nó
trớ
nên
bền
vững
và
có
ảnh
hưởng
lớn
đến
cấu
trúc
và
tính
chất
của
các
chất..
Sau
chương
này
chúng
ta
sẽ
thấy
được
các
liên
kết
Hyđro
trong
phân
tử
nước
tạo
ra
rất
nhiều
đặc
tính
làm
cho
nước
trở
nên
không
thể
thiếu
trong
cơ
thể
sống.
Liên
kết
Hyđro
cung
đóng
một
vai
trò
quan
trọng
kiểm
soát
và
duy
trì
dạng
ba
chiều
của
các
đại
phân
tử
như
ADN
và
các
Protein(xem
chương
3)
Liên kết ion hình thành từ lực hút điện tử Khi 1 nguyên tử có độ âm điện lớn hơn nhiều so với nguyên tử tương tác với nó, xảy ra sự chuyển rời của một hay nhiều điện tử.Xem xét hai nguyên tử Natr ( độ âm điện 0.9) và Clo (3.1). Một nguyên tử Natri chỉ có 1 điện tử ở lớp vỏ ngoài ; điều kiên này không bền. Một nguyên tử Clo có 7 điện tử ở lớp vỏ ngoài - trạng thái này cũng không bền. Do độ âm điện của các nguyên tố này rất chênh lệch nhau,một vài điện tử trong liên kết sẽ tiến đến rất gần hạt nhân Clo đến mức mà trong thực tế đã là sự chuyển rời hoàn toàn điện tử từ nguyên tử này sang nguyên tử khác.(hình 2.13) Tương tác giữa Natri và Clo làm cho các nguyên tử ở trạng thái bền vững hơn. Đó là liên kết Ion.Ion là các tiểu phần mang điên tích được tạo thành khi nguyên tử mất đi hay nhận thêm một hay nhiều điện tử. - Ion Natri (Na+) có điện tích +1 vì nó có số lượng điện tử ít hơn 1 so với số proton. Lớp vỏ ngoài của Natri đựợc lấp đầy với 8 điện tử để ion ở trạng thái bền vững. Các ion mang điện tích dương được gọi là các cation. - Ion Clo (Cl-)có điện tích là -1 vì nó có số điện tử nhiều hơn 1 so với số proton. Thêm vào 1 điện tử ,Cl- có lớp vỏ bến vững với 8 điện tử. Các ion mang điện tích âm được gọi là các anion. Một số nguyên tố tạo thành ion mang điện tích lớn khi bị mất hoặc nhận thêm hơn 1 điện tử.Ví dụ : ion Ca2+(ion canxi được tạo ra từ nguyên tử Canxi bị mất hai điện tử) và ion Mg2+ (ion magiê).Hai nguyên tố quan trọng trong sinh học trong đó mối nguyên tố có 2 loại ion bền là :sắt với Fe2+ ( ion Sắt II) và Fe3+ (ion sắt III); đồng với Cu+ (ion đồng I) và Cu2+ (ion đồng II). Các nhóm nguyên tử liên kết cộng hoá trị mang điện tích được gọi là các ion phức. Ví dụ như NH4+(ion amoni), SO42-(ion sunphat), và PO43- (ion photphat)
Điện
tích
từ
các
ion
phát
ra
theo
mọi
hướng.
Khi
được
hình
thành
các
ion
thường
ở
dạng
bền
vững.chúng
không
bị
mất
đi
hay
nhận
them
các
điện
tích
nữa.
Các
ion
hình
thành
liên
kết
bền
thường
là
dạng
rắn
như
Natri
Clorua
(NaCl)
và
Kali
Photphat
(K3PO4).
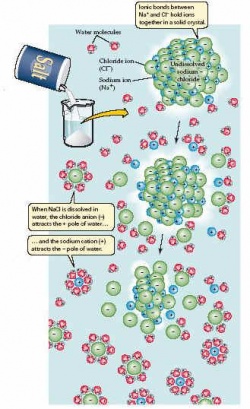
Liên kết ion là liên kết được hình thành do lực hút tĩnh điện giữa hai ion có điện tích trái dấu. Natri Clorua - loại muối ăn quen thuộc với chúng ta- các cation va anion liên kết với nhau bằng liên kết ion. Trong chất rắn, liên kết ion rất mạnh vì các ion tương tác rất chặt chẽ với nhau. Tuy nhiên khi các ion này được phân tán vào nước khoảng cách giữa chúng lớn hơn lực liên kết giữa chúng giảm đi rất nhiều. Trong môi trường tế bào lực ion nhỏ bằng 1/10 lực liên kết cộng hoá trị không phân cực.(xem bảng 2.1) Không có gì ngạc nhiên, khi các ion với một hay nhiều đơn vị điện tích có thể tương tác với các phân tử phân cực cũng như với các ion khác. Tương tác như vậy đựoc tạo ra khi muối hay một ion rắn náo đó tan trong nước :các phân tử nước tạo thành lớp vỏ bao quanh mỗi ion và chia tách chúng ra (hình 2.14). Liên kết Hyđro mà chúng ta đã mô tả cũng là một loại liên kết ion bởi vì nó được hình thành từ lực hút tĩnh điện .Tuy nhiên nó yếu hơn nhiều so với liên kết ion vì nó hình thành từ các điện tích thành phần (δ+ và δ-) nhỏ hơn các điện tích đơn vị toàn phần (+1 hoặc -1).
Các chất phân cực và không phân cực tương tác với nhau
“Giống nhau thì bám nhau” là một ngạn ngữ cổ và nó được thể hiện đúng nhất trong các phân tử phân cực và không phân cực, vốn có xu hướng tương tác với "đồng loại" của chúng. Cũng như các phân tử nước tương tác với nhau qua liên kết hydro do sự phân cực tạo ra, bất kỳ phân tử phân cực nào sẽ tương tác với các phân tử phân cực khác bằng lực hấp dẫn yếu (δ+ đến δ-)trong các liên kết hydro. Nếu một phân tử phân cực tương tác với nước theo cách này thì chúng được gọi là các phân tử ưa nước (“ái nước”). Thế còn các phân tử không phân cực thì sao? Ví dụ Cacbon (độ âm điện 2.5) hình thành liên kết không phân cực với Hyđro (độ âm điện 2.1). Phân tử Hyđrocacbon được tạo thành - tức một phân tử chỉ chứa các nguyên tử Hyđro và Cacbon - là một phân tử không phân cực, và trong nước chúng có xu hướng co cụm với các phân tử không phân cực khác thay vì với các phân tử nước phân cực. Những phân tử như vậy được biết dưới tên gọi các phân tử kị nước (“ghét nước”), và tương tác giữa chúng gọi là tương tác kị nước. Một điều quan trọng là các chất kị nước không thực sự “ghét” nước ; chúng có thể hình thành các tương tác yếu với nước (nhớ lại độ âm điện của Cacbon và Hyđro không bằng nhau chính xác). Nhưng các tương tác này yếu hơn nhiều so với liên kếtHyđro giữa các phân tử nước, vì vậy các chất không phân cực sống rất tách biệt. Các tương tác yếu giữa các chất không phân cực được tăng cường bởi lực Van der Waals, sinh ra khi hai phân tử không phân cực ở rất gần nhau. Những tương tác ngắn ngủi này là kết quả của sự biến thiên ngẫu nhiên trong sự phân bố electron trong phân tử, tạo ra sự phân phối các điện tích trái dấu ở hai phân tử nằm cạnh nhau. Mặc dù chỉ một liên kết Van de Waals thì rất ngắn ngủi và yếu ở mọi vị trí, nhưng tổng của rất nhiều các tương tác như vậy trên toàn bộ cấu trúc một phân tử không phân cực lớn có thể tạo ra một lực hấp dẫn rất lớn. Lực Van de Waals rất quan trọng trong việc duy trì cấu trúc của rất nhiều hợp chất sinh học quan trọng.
Các phản ứng hóa học : Nguyên tử đổi bạn[sửa]
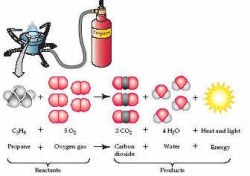
Một phản ứng hóa học xảy ra khi nguyên tử kết nối hay làm thay đổi liên kết của chất đồng tham gia phản ứng. Xét phản ứng cháy xảy ra trong ngọn lửa của propane. Khi propane (C3H8) phản ứng với khí oxi (O2), nguyên tử carbon sẽ liên kết với oxy thay vì với nguyên tử hydrô, và nguyên tử hydrô sẽ liên kết với oxy thay vì với carbon (Hình 2.15). Khi những nguyên tử cộng hóa trị thay đổi liên kết của các chất tham gia, thành phần của phản ứng thay đổi, propane và khí oxy trở thành khí carbonic và nước. Phản ứng hóa học này có thể được biểu diễn bằng phản ứng sau:
C3H8 + 5O2 -> 3CO2 + 4H2O + năng lượng
Hình 2.14: Trong phản ứng này, propane và oxy là những chất tham gia phản ứng, và carbon dioxide và nước là những sản phẩm tạo thành. Trong trường hợp này, phản ứng là hoàn toàn: tất cả propane và oxy được sử dụng hết để tạo thành 2 sản phẩm trên. Hướng mũi tên chỉ chiều của phản ứng. Chỉ số đứng trước mỗi phân tử dùng để cân bằng phản ứng và đồng thời chỉ số lượng phân tử đã được sử dụng hay tạo thành.
Trong phản ứng này, cũng như trong tất cả các phản ứng hóa học khác, vấn đề không phải là tạo thành hay phân hủy chất gì. Mà vấn để chính là: tổng số phân tử carbon bên vế trái của phương trình phản ứng bằng với tổng số carbon có bên vế phải. Tuy nhiên, có 1 sản phẩm khác cũng được tạo thành sau phản ứng: đó là năng lượng. Nhiệt và quang của lò phản ứng chứng tỏ rằng phản ứng của propane và oxy giải phóng 1 lượng năng lượng lớn. Năng lượng được định nghĩa như là khả năng làm việc, nhưng trên phương diện trực giác, nó cũng có thể được xem như khả năng để thay đổi. Các phản ứng hóa học không tạo ra hay tiêu tốn năng lượng, nhưng thay đổi năng lượng luôn đi kèm với phản ứng hóa học.
Trong phản ứng giữa propane và oxy, năng lượng giải phóng ra nhiệt và quang đã có sẵn trong các chất tham gia phản ứng từ trước dưới 1 dạng khác, được gọi là năng lượng hóa học tiềm tàng. Trong 1 vài phản ứng hóa học, năng lượng phải được cung cấp từ môi trường (ví dụ, 1 vài chất chỉ sẽ phản ứng khi được đốt nóng), và 1 số nguồn cung cấp năng lượng này được trữ dưới dưới dạng năng lượng hóa học tiềm tàng trong các liên kết được hình thành trong sản phẩm.
Chúng ta có thể đo được năng lượng trong các phản ứng phản ứng hóa học bằng cách sử dụng đơn vị gọi là calorie (cal). 1 calorie là 1 lượng nhiệt cần để tăng nhiệt độ của 1gram nước tinh khiết lên 1 độ: từ 14,5oC lên 15,5oC. Một đơn vị năng lượng khác cũng thường được sử dụng nữa là Joule (J). Khi ta so sánh năng lượng với nhau, ta luôn so sánh joules với joules hay calories với calories. Hai đơn vị này có thể chuyển đổi qua lại: 1J = 0,233cal, và 1cal = 4,184j. Ví dụ: 486 cal = 2,033J, hay 2.033 kJ. Mặc dù được định nghĩa là năng lượng nhiệt, nhưng 2 đơn vị calorie và joule còn được dùng để đo bất kỳ dạng năng lượng nào – cơ năng, điện năng, hay hóa năng.
Nhiều phản ứng sinh học cũng giống như sự cháy của propane. Thay vì nhiên liệu là propane, thì nhiên liệu ở đây là đường glucose và phản ứng diễn ra qua nhiều bước trung gian, những bước này sẽ giữ lại năng lượng giải phóng từ glucose để cung cấp cho tế bào sử dụng. Nhưng sản phẩm của các phản ứng sinh học cũng tương tự như trong phản ứng hóa học: đều tạo thành carbon dioxide và nước. Những phản ứng này là chìa khóa của nguồn gốc các loài từ các phân tử đơn giản. Chúng ta sẽ giới thiệu và thảo luận về các thay đổi của năng lượng, các phản ứng oxi hóa – khử, và nhiều dạng khác của các phản ứng hóa học thông dụng trong hệ thống sống trong phần sau.
Nước : cấu trúc và các tính chất[sửa]
Nước, cũng giống như các vật chất khác, có thể tồn tại ở 3 thể: rắn, lỏng, khí. Nước ở thể lỏng là môi trường bắt nguồn sự sống trên trái đất, và trong nước thì sự sống đã phát triển nên từ những tỉ năm đầu tiên. Trong đoạn này, chúng ta sẽ tìm hiểu tại sao cấu trúc và tương tác giữa các phân tử nước lạI làm nước trở thành nhân tố chính của cuộc sống.
Nước có cấu trúc và tính chất đặc biệt duy nhất[sửa]
Phân tử nước H2O, có một nét đặc trưng duy nhất. Như chúng ta đã đề câp ở đoạn trước thì nước là một phân tử phân cực do các liên kết hydrogen. Thêm nữa, hình dạng của phân tử nước là tứ diện. Bốn cặp điện tử nằm ngoài lớp vỏ liên kết với một điện tử của phân tử nước khác, và tạo nên cấu trúc tứ diện .
Nét đặc trưng hoá học đó giải thích một vài tính chất đặc biệt của nước, như khả năng của nước đã nổi trên mặt nước, nhiệt độ nóng chảy và nhiệt độ đóng băng của nước , khả năng của nước bảo quản nóng và khả năng nhỏ giọt của nước. Các tính chất này được nói đên chi tiết ngay sau đây.
2.16 Hydrogen Bonds Hold Water Molecules Together Hydrogen bonding exists between the molecules of water in both its liquid and solid states.
- Băng trôi: Ở trạng thái rắn, phân tử nước riêng biệt được giử tạI các vị trí do các liên kết hydrogen, tạo ra cấu trúc rắn và tinh thể trong đó một phân tử nước liên kết vớI 4 phân tử nước khác ( hình 2.16a). Mặc dù các phân tử được giữ vững chắc tạI chỗ, nhưng nó vẫn không nhồI nhét một cách chặt chẽ như ở trạng thái lỏng ( hình 2.16b). Nói cách khác, nước đá không nặng bằng nước ở thể lỏng, vì thế đá có thể nổi trên nước.
Nếu đá được tạo thành trong nước, gíống như tất cả các phân tử rắn khác khi biến thành thể lỏng, các biển và hồ nước có thể đóng băng từ phia trên, trở thành khối nước rắn trong mùa đông và tiêu diệt tất cả vi sinh vật sống trong đó. Khi mà toàn bộ mặt biển bị đóng băng, nhiệt độ của nó có thể giảm xuông dưới nhiệt độ điểm đóng băng. Tuy nhiên, bởi vì đá thì nổi trên nước nên hình dạng của nó có một lớp bảo vệ trên bề mặt biển, giảm nhiệt độ nước chảy vào không khí lạnh ở phía trên. Vì vây, các loài cá, thực vật và các cơ thể sống khác trong biển không bị ảnh hưởng bởI nhiệt độ thấp hơn 0°C, nhiệt độ đóng băng của nước. Phát hiện gần đây về nước lỏng ở phái dưới băng cực trên sao Hoả cho phép suy đoán là cuộc sống có thể tồn tạI trong môi trường đó.
- Sự nóng chảy và đóng băng:Nước là máy điều tiết khi nhiệt độ thay đổi. So sánh giữa các thể khác nhau có cùng thể tích, thì phần tử nước đá cần có một năng lượng lớn để có thể tan chảy. Để tan chảy 1mol (6,02x1023 nguyên tử, số lượng chuẩn, xem trang 28) nước cần cung cấp một năng lượng 5,9 kj. Giá trị này khá cao vì cần cắt đứt liên kết hydrogen để nước chuyển từ thể rắn sang lỏng. Quá trình ngược lại là đóng băng, một phần lớn năng lượng bị mất đi khi mà nước chuyển từ thể lỏng sang rắn.
- Sự lưu kho nóng: nước góp phần cho sự ổn đinh nhiệt một cách đáng kinh ngạc ở trong các đại dưong và các hồ nước lớn trong nhiều năm trời. Sự thay đổi nhiệt độ ở các vùng ven biển cũng được điều hoà bởi một lượng lớn nước. Thực ra nước giúp cho việc thay đổi ít nhất nhiệt độ khí quyển trên trái đất.
- Sự điều hoà này là do nước có nhiệt dung lớn. Tỉ nhiệt của một chất được tính bằng năng lượng nhiệt cần thiết để làm 1g chất đó tăng thêm 1°C. Sự tăng nhiệt độ của nước lỏng cần một lượng nhiệt lớn để phá vỡ liên kết hydrogen. So sánh với các phân tử nhỏ chất lỏng khác thì nước có tỉ nhiệt lớn nhất.
- Sự bay hơi và làm mát: Nước có nhiệt hóa hơi cao, có nghĩa là cần lượng nhiệt lớn để nước có thể chuyển nước từ trạng thái lỏng sang khí (qúa trình bay hơi). Một lần nữa, phần lớn năng lượng là để cắt liên kết hydrogen của nước. Lượng nhiệt này cần được hấp thu từ môi trường tiếp xúc với nước. Như vậy thì sự bay hơi có tác dụng làm mát môi trường như lá cây, rừng, hay toàn bộ các vùng đất rộng lớn. Hiệu ứng này giải thích tại sao mà con người lại đổ mồ hôi ra ngoài da, nó diễn ra khi nhiệt độ cơ thể tăng cao.
- Sự dính kết và sức căng bề mặt: Trong nước ở thể lỏng, mỗI phân tử nước đơn có khả năng tự do dao động. Các liên kết hydrogen giữa các phân tử liên tục được hình thành và phá vỡ. Nói cách khác, nước lỏng có một cấu trúc năng động. Kết quả là mỗI một phân tử nước hình thành nên 3,4 liên kết hydrogen với các phân tử khác. Số lượng đó thường là không nhiều ở nước đá, nhưng nó cũng khá cao. Liên kết hydrogen giải thích sự dính kết cao của nước lỏng. Cường độ dính kết cho phép một cách giới hạn sự căng ra của cột nước từ gốc cây đến lá có khi đến hàng trăm mét.
Khi nước bay hơi từ lá cây. Toàn bộ cột nước di chuyển lên trên để đẩy các phân tử lên cao.
Nước cũng có sức căng bề mặt lớn, điều đó có nghĩa là bề mặt của nước lỏng tiếp xúc với không khí thì khó đâm thủng được màng nước. Các phân tử nước ở lớp bề măt này liên kết với các phân tử ở lớp dưới nhờ liên kết hydrogen. Sức căng bề mặt của nước cho phép dụng cụ chứa nước có thể chứa nước ở một mức nhất định phiá trên mặt dụng cụ mà không bị tràn ra, và điều đó cho phép các động vật nhỏ đi trên mặt nước (hình 2.17)
2.17 Surface Tension Water striders “skate” along, supported by the surface tension of the water that is their home.
Nước - Dung môi của cuộc sống[sửa]
Cơ thể sinh vật có tới 70% là nước., Ngoại trừ các vật liệu như là xương có chứa rất it nước, thì các bộ phận khác trong cơ thể đều chứa rất nhiều nước. Nhiều phản ứng phân giải cơ chất trong cơ thể phải được thực hiện trong môi trường nước. Một quá trình hoà tan khi một chất(chất tan) vào một chất lỏng (dung môi) như là nước thì tạo thành một dung dịch. Nhiêu phân tử quan trọng trong hệ thống sinh học là có cực,như các phân tử protein, đường vv...nên chúng cũng có thể hoà tan trong nước. Phân tích phẩn ứng trong dung dịch nước có thể được chia làm hai hướng:
-phân tích định tính giúp ta xác định được thành phần các cháttan trong dung môi và những chất do phản ứng hoá học trong dung môi tạo ra. Phân tích định tính là một vấn đề đuợc đề cập nhiều trong vài chương tới.
-Phân tích định lượng đo nồng độ, hoặc là khôi lượng của một chất trong khối lượng của dung dịch. Theo những thông tin mà ta đo được có thể định luợng được chất hoá học chúng ta cần kiểm tra.
Quy tắc để định lượng trong sinh học cũng như trong hoá học là nộng độ phân tử gam, một phân tử gam là khối lượng của một ion hay hợp chất ( tính bằng gram) khối lượng phân tử đánh giá mức độ của phân tử. Ví dụ một phân tử đường có công thức là (C12 H22 O11 ) thì có khối lượng là 342 gram.
Mục đích khác của phân tích khối lựợng đó là nghiên cứu con số chính xác của các phân tử trong dung dịch. Nhưng nó không thể xác định khối lượng của các phân tử một các trức tiếp, Thay vào đó, hoá học sử dụng hằng số trung gian để tính khối lượng của của các chất từ số phân tử chứa trong chất đó. Hằng số này gọi là hằng số Avogadro bằng 6.02. 1023 là số phân tử chứa một phân tử gam chất. Một phân tử có giá tị được chấp nhận là 12 gram, ta có thể hiểu theo cách này thì khi một bác sĩ tiêm một nồng độ phân tử gam xác định vào máu của bệnh nhân, thì bằng phương pháp tính toán thô, có thể tính toán được số phân tử thuốc mà chúng sẽ tương tác với những tế bào của bệnh nhân. Cũng theo cách này, chất hoá học có thể hoà tan một phân tử gam của đừơng trong dung dịch nước làm thành một lit dung dịch,một mol chất có 6.02.10 23 phân tử do đó trong một lit nước cũng có số phân tử là 6.02.10 23 .Người ta gọi dung dịch của một mol của chất tan trong một lit dung môi nước được gọi là 1 nồng độ molit (1M).Tuy nhiên trong các mô sống nồng độ của các chất tan là rất nhỏ có thể không đến một molar vì thế chúng được tính ở những đơn cị nhỏ hơn như mM và µM . một Mm bằng 1/1000 M và µM bằng 1/1000mM
Acid, base và chuẩn độ pH[sửa]
Khi các cơ chất hoà tan trong nước, chúng phóng thích các ion hydro ( H+ ), proton mang điện tích dương, riêng lẽ. Các hạt mang điện nhỏ bé này có thể gắng kết với các phân tử , vì thế sẽ thay đổi tính chất của chúng. Ví dụ, các hạt proton trong cơn mưa acid có thể làm tổn thưong tới các cây thực vật, và bạn có thể quen với việc quá lượng acide trong dạ dày ảnh hưởng đến tiêu hóa. Trong phần này chúng ta sẽ chỉ tham khảo các tính chất của các chất phóng thích H+ ( gọi là acid ) và những chất nhận H+ ( gọi là kiềm ). Chúng ta sẽ phân biệt acide, kiềm yếu ,mạnh và đưa ra định nghĩa tương đối về nồng độ H+ trong dung dịch : the pH scale – cân độ pH
Acid cho H+, base nhận H+[sửa]
Nếu acid hydrochloric thêm vao nước, sẽ bị phân ly và phóng thích ion H+và ion Cl-
HCl → H+ + Cl-
nếu nồng độ H+ tăng , dung dịch acid. Tương tự như phản ứng đốt cháy propane và oxy ( xem hình 2.15), sự hòa tan HCl tạo các ion là một phản ứng hoàn toàn. HCl sẽ được gọi là môt acide mạnh.
Acid se phóng thích ion H+ trong trong dung dịch. HCl là một acid, như acidesulfuric H2SO4. Một phân tử acid sulfuric bị ion thành 2 H+ và 1 SO42-. Các hợp chất sinh học có chứa các –COOH ( nhóm carboxyl)cũng được gọi là các acid ( như acid acetic CH3COOH và acid pyruvic CH3COCOOH); vì
HCO-OH → -COO - + H+
Không phải tất cả các acid hòa tan hoàn toàn trong nước. ví dụ, acid acetic cộng với nước , phản ứng xảy ra không hoàn toàn nên acid acetic gọi là acid yếu.
Kiềm nhận ion H+. Giống như acid, kiềm cu-‘ng có kiềm mạnh và kiềm yếu. Nếu như sút ( NaOH) thẹm vào nước, nó dẽ bị hòa tan và phân ly, cho ra ion OH- và ion Na+
NaOH → Na+ + OH–
Bởi vì nồng độ pH tăng và ion OH- hấp thụ ion H+ tạo ra phân tử nước.dung dịch gọi là dung dịch baz. Và phản ứng xảy ra hoàn toàn nên NaOH gọi là một baz mạnh. Các baz yếu như : ion bicarbonate HCO3-, có thể chấp nhận ion H+, và trở thành acid carbonic (H2CO3); amonia (NH3) nhận H+ và trở thành NH4+. Nhóm chức amino chấpnhận các ion H+ nên được xem như là các baz.
-NH2 + H+ → - NH3+
Phản ứng acide-base là phản ứng thuận nghịch.[sửa]
Khi acid acetic hòa tan trong nước, hai phản ứng xảy ra. Đầu tiên, acid acetic tạocácions :
CH3COOH → CH3COO- + H+
Sau đó, khi mà ion đã được tạo ra, chúng tái kết hợp lại thành acid acetic:
CH3COO- + H+ → CH3COOH
Cặp phản ứng trên thuận nghịch. Một phản ứng thuận nghịch có thể diễn ra theo hai hướng, từ phải sang trái, hay từ trái sang phải, tùy vào nồng độ chất phản ứngvà sảnphẩm tạo ra. Công thức cho một phản ứng thuận nghịch được thể hiện bằng dấu hai mũi tên:
CH3COOH ↔ CH3COO- + H+
Về nguyên tắc, tất cả các phản ứng hóa học xảy ra hai chiều. Đối với acid và bazơ có hai loại phản ứng hoá học, dựa theo mức độ thuận ngược:
-Sụ ion hóa các acid và base mạnh thì coi như không thuận nghịch. -sự ion hóa các acid và base yếu có phần thuận nghịch.
Nhiều nhóm acid và base trong hệ thống các đại phân tử thì yếu.
Nước là một acid yếu.[sửa]
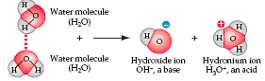
Phân tử nước hơi có xu hướng ion hóa thành ion hydroxide OH- và ion hydro H+ nhưng điều này rất có ý nghĩa. Thực ra có hai phân tử nước tham gia quá trình ion hoá này. Một trong hai phân tử sẽ bắt lấy một ion hydro, tạo một ion hydro (H+) và một ion hydronium (H3O+)
Sự ion hoá nước rất quan trọng các sinh vật sống. Dữ kiện này có lẽ gây ngạc nhiên là chỉ có một phân tử nước trong 500 triệu phân tử bị ion hoá ở bát kì thời điểm nào. Chúng ta sẽ ít b-&t ngờ hơn nếu tập trung vào sự dồi dào nước trong hệthống sinh vật và bản chất phảnứng của ion H+ sản xuát triong quá trình ion hóa.
pH là thước đo nồng độ ion hydro.[sửa]
Thuật ngữ acidic và basic liên quan tới dung dịch. Dung dịch acide hay baz là tùy thuộc vào mối liên quan nồng độ của ion H+ và ion OH-. Từ ngữ acid và baz đề cập tới các hởp chất và các ion. Một hợp chất hay ion acid cho H+, và hợp chất,ion baz nhận H+
Làm thế nào chúng ta phânbiệt được dung dịch acid hay dung dịch baz ?
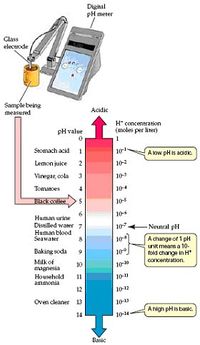
Đầu tiên, nhìn vào nồng độ ion H+ của dung dịch tương phản. Nồng độ diễ tả ở nồng độ mol, số lượng mol của hợp chất trong một lít dung dịch. ( trang 28 ). Nước tinh khiết , nồng độ ion H+ là 10-7 mol/lit. Trong 1M acid hydrochloric, nồng độ ion H+ là 1M ; trong 1M dung dịch sút, nồng độ H+ là 10-14 Bời vì thang giá trị khá rộng, nồng độ ion H+ là thước đo không thíchhợp. Để đơn giản hơn, người ta dùng nồng độ logarithm, vì nồng độ loga giảm thang giá trị.
Chúng ta chỉ ra dung dịch acid hay baz bằng độ pH. Giá trị pH địnhnghĩa giá trị âm logarithm của nồng độ ion hydro trong 1 lit dung dịch ( nồng độ mol ). Trong ký hiệu hoá học, nồng độ mol thường được biểu thị trong dấu ngoặc đơn. Ví dụ [H+] biểu thị nồng độ mol của ion H+ .
Công thức pH :
pH = - log 10[H+]
Khi nồng độ H+ của nước tinhkhiết là 10 -7)M, nồng độ pH của nó là pH = - log(10-7)= -(-7) hay 7 . Logarít âm càng nhỏ nghĩa là số càng lớn. Giá trị pH thấp nghĩa là nồng độ ion H+ cao hay là tính acid càng lớn.
Trong 1M HCl, nồng độ H+ là 1M, vì thế pH là giá trị loga âm của 1 (-log10 ) bằng 0. pH của 1M NaOH là giá trị âm của loga 10-14 bằng 14.
Một dung dịch pH nhỏ hơn 7 mang tính acid, chứa nhiều ion H+ hơn là ion OH- ; một dung dịch pH 7 trung tinh ; dung dịch pH lớn hơn 7 là baz.
Xem hình 2.18 hiển thị các giá trị pH của vài chất thông thường.
Dung dịch đệm hạn chế tối thiểu sự thay đổi pH[sửa]
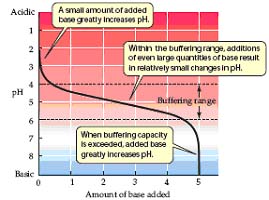
Một số sinh vật , có lẽ có cả các sinh vật đầu tiên sống và thích ứng trơng những môi trường có pH cực đoan. Tuy nhiên đa số sinh vật kiểm soát pH của các khoang riêng biệt bên trong tế bào của chúng. Ví dụ pH bình thường của tế bào hồng cầu người là 7,4 và chỉ cần sai khác 1/10 của một đơn vị pH cũng có thể gây chết. Việc kiểm soát pH thực hiện được là nhờ dung dịch đệm : là một hỗ hợp các chất hoá học có thể duy trì pH tương đối ổn định ngay khi thêm hay bớt một lượng acid hay base đáng kể.
HCO3- + H+ ↔ H2CO3
Nếu như 1 baz thêm vào, phản ứng cần dảo ngược. Vài acid carbonic ion hóa sản xuất ion bicarbonate và nhiều ion H+ . Bằng cách nay , dung dịch đệm giảm được ảnh hưởng của việc thêm hay bớt acid hay baz trện pH. Ở máu , hệ thống dung dịch đệm qua trọng trong việc ngăn ngừa nhữ thay đổi có ý nghĩa trong pH có thể ngăn cản chức năng vận chuyển O2 đến các mô và cơ quan. Một lượng thêm acid hay baz gây nên sựthay đổi nhỏ pH trong dung dịch đệm hơn là trong dung dịch không đệm ( xem hình 2.19 )
Dung dịch đệm minh họa nguyên tắc hóa học chính trong phản ứng thuận nghịch gọi là qui luật khối lương chất ( law of mass action ) . Sự thêm một chất phản ứng ở một chiều của hệ thống thuận ngươc sẽ đưa đến phản ứng theo chiều sử dụng các phức hợp. Trong trường này , thêm môt acid đưa đấn phản ứng theo 1 chiếu, thêm 1 baz theo chiều phản ứng ngược lại.
Các đặc tính của phân tử[sửa]
Hơn nữa, chương này đã thảo luận về những tính chất của phân tử, gồm kích thước, tính phân cực, độ hoà tan, và tính acid/bazơ. Hai tính quan trọng khác ảnh hưởng đến hoạt động của phân tử trong phản ứng hóa học là sự hiện diện của nhóm chức năng nhận biết và sự tồn tại của những đồng phân khác của phân tử với cùng công thức.
Một vài nhóm nhỏ nguyên tử được gọi là những nhóm chức được tìm thấy trong nhiều phân tử, thực tế đơn giản hóa sự hiểu biết của chúng ta về phản ứng của phân tử trải qua trong tế bào sống. Mỗi nhóm chức có những tính chất riêng biệt, khi gắn chặt vào 1 phân tử lớn hơn, phân tử lớn sẽ có những tính chất đó. Bạn sẽ bắt gặp nhiều nhóm chức trong nghiên cứu sinh học, kể cả cồn, aldehyt, ketone, acid, amin, phophat và thiol.
Một phạm trù quan trọng của những phân tử sinh học chứa những nhóm chức là acid amin, vừa có cả nhóm cacboxyl và nhóm amin gắn chung 1 nguyên tử cacbon, gọi là alpha carbon. Cũng gắn vào nguyên tử alpha carbon là nguyên tử hydro và 1 chuỗi bên hay nhóm R, chỉ rõ bởi R
Những chuỗi bên khác nhau có thành phần hóa học, cấu trúc và tính chất khác nhau. Cứ mỗi 20 acid amin tình thấy trong protein có chuỗi bên khác nhau thì có thành phần hóa học riêng biệt, sẽ học ở chương 3. Bởi vì đều có cả nhóm carboxyl và nhóm amin, nên acid amin đồng thời là acid lẫn bazo. Giá trị của pH thường được tìm thấy trong tế bào, cả nhóm carboxyl và amin đều được ion hóa: nhóm carboxyl bị mất 1 proton và nhóm amino có 1 proton.
Chất đồng phân có cách sắp xếp nguyên tử khác nhau Đồng phân là những phân tử có cùng công thức hóa học nhưng có cách sắp xếp nguyên tử khác nhau. (Tiền tố iso-, nghĩa là "giống nhau" thường được thấy trong nhiều thuật ngữ sinh học.) Một loại đồng phân khác, chúng tôi xem xét 2 loại: đồng phân cấu trúc và đồng phân quang học.
Đồng phân cấu trúc khác ở chỗ cách nguyên tử nối với nhau như thế nào. Xem xét 2 phân tử đơn giản, mỗi phân tử chứa 4 nguyên tử carbon và 10 nguyên tử hydro, có cùng công thức C4H10. Những nguyên tử này có thể nối với nhau theo 2 cách, hình thành 2 dạng phân tử. Quan hệ liên kết khác nhau của butane và isobutene được phân biệt bởi công thức, và 2 hợp chất có tính chất hóa học khác nhau.
Đồng phân hình học xảy ra khi 1 nguyên tử carbon có 4 nguyên tử khác hay nhóm khác gắn vào nó. Kiểu này cho phép 2 cách gắn khác nhau, mỗi cái là hình ảnh trong gương của cái kia. Như vậy, một nguyên tử carbon là 1 nguyên tử carbon ko đối xứng, và cặp hợp chất là đồng phân quang học của cặp kia. Bạn có thể tưởng tượng tay phải và trái của bạn giống như đồng phân quang học. Giống như găng tay là dành riêng cho bàn tay, một vài phân tử hóa sinh có thể tác động với 1 đồng phân quang học của cùng 1 hợp chất, nhưng ko thể với cái kia.
Carbon alpha là 1 acid amin, 1 carbon không đối xứng bởi vì nó được nối với 4 nhóm chức khác nhau. Vì vậy, acid amin tồn tại ở 2 dạng đồng phân, là dạng acid amin D và dạng acid amin L. D và L lần lượt là chữ viết tắt của thuật ngữ Latin của từ "phải" (dextro) và "trái" (levo). Chỉ có L-acid amin được tìm thấy trong hầu hết các sinh vật, sự có mặt của nó là 1 dấu hiệu hóa học quan trong cho cuộc sống
Nãy giờ chúng ta đã bao quát những tính chất chính của tất cả phân tử, hãy xem lại chúng ở chương kế có đề cập đến những phân tử chính của hệ thống sinh học
Phân tử có sự đa dạng về kích thước. Một vài phân tử có kích thước nhỏ, như H2 và CH4. Những phân tử khác thì lớn, như phân tử đường, có 45 nguyên tử. Còn có những phân tử, đặc biệt là protein như hemoglobin (chất vận chuyển oxygen trong tế bào máu) có kích thước khổng lồ, thỉnh thoảng chứa 10.000 nguyên tử. Sự hình thành phân tủ lớn từ những phân tử đơn giản hơn trong môi trường là chìa khóa mở ra sự sống trong kỳ Archean.
_Tất cả mọi phân tử đều có hình không gian 3 chiều. Ví dụ, sự định hướng của qũy đạo nối quanh nguyên tử C như phân tử metan CH4 có hình tứ diện đều (hình 2.10c). Ở phân tử CO2, 3 nguyên tử đứng thẳng hàng. Những phân tử lớn có hình dạng phức tạp là do số lượng và loại nguyên tử và cái cách mà chúng nối với nhau. Một vài phân tử lớn như hemoglobin rất rắn chắc như hình trái banh. Những loại khác, protein như keratin cấu tạo nên tóc thì dài, mỏng có cấu trúc như dây cáp. Hình dạng của chúng có quan hệ với vai trò của những phân tử trong tế bào sống.
_Tính chất hóa học của phân tử xác định vai trò sinh học của nó. Những nhà hóa học dùng đặc điểm của hợp chất, cấu trúc (dạng ko gian 3 chiều), khả năng phản ứng và tính hòa tan để phân biệt 1 mẫu nguyên chất của 1 phân tử với một mẫu phân tử khác. Sự hiện diện của nhóm chức có thể có những tính chất hóa học để phân biện với những phân tử khác, cũng như sự sắp xếp vật lý của nguyên tử thành dạng đồng phân
Giữa những phân tử đề cập trong chương này và trong thế giới của tế bào sống đúng là những đại phân tử. Những phân tử khổng lồ này - proteins, lipids, carbonhydrates, và nucleic acids - sẽ được đề cập ở chương kế.