Lecture:Sinh học Đại cương MIT 7.013/Chapter 6
Mục lục
- 1 Năng lượng, enzyme và quá trình chuyển hóa
-
2
Năng
lượng
và
sự
chuyển
đổi
năng
lượng
- 2.1 Biến đổi năng lượng liên quan đến biến đổi vật chất
- 2.2 ĐỊNH LUẬT THỨ NHẤT: NĂNG LƯỢNG KHÔNG TỰ NHIÊN SINH RA CŨNG KHÔNG TỰ NHIÊN MẤT ĐI
- 2.3 Không phải tất cả các năng lượng có thể sử dụng và hỗn loạn có xu thế tăng
- 2.4 Các phản ứng hóa học giải phóng hoặc hấp thu năng lượng
- 2.5 Cân bằng hóa học và năng lượng tự do có liên quan đến nhau
-
3
ATP:
Transferring
energy
in
cells
- 3.1 ATP hydrolysis releases energy
- 3.2 ATP couples exergonic and endergonic reactions
- 3.3 Enzyme chất xúc tác sinh học
- 3.4 For a reaction to proceed an energy barrier must be overcome
- 3.5 Enzyme bind specific reactant molecules
- 3.6 Enzyme làm giảm rào cản năng lượng nhưng không làm thay đổi điểm cân bằng của phản ứng
- 3.7 What are the chemical events at active sites of enzymes?
- 3.8 cấu trúc phân tử quyết định chức năng của enzyme
- 3.9 TRUNG TÂM HOẠT ĐỘNG CÓ TÍNH ĐẶC HIỆU VỚI CƠ CHẤT
- 3.10 Enzyme thay đổi cấu hình không gian khi gắn với cơ chất
- 3.11 Một số enzyme cần các phân tử khác để có thể hoạt động
- 3.12 Nồng độ cơ chất ảnh hưởng đến tốc độ phản ứng
- 3.13 Quá trình chuyển hóa và sự điều hòa của enzyme
- 3.14 Metabolism is organized into pathways
- 3.15 Enzyme activity is subject to regulation by inhibitors
- 3.16 CÁC ENZYME BIẾN CẤU ĐIỀU KHIỂN HOẠT TÍNH CỦA CHÚNG BẰNG CÁCH THAY ĐỔI CẤU HÌNH
- 3.17 Allosteric effects regulate metabolism
- 3.18 Enzymes are affected by their environment
Năng lượng, enzyme và quá trình chuyển hóa[sửa]
Hằng triệu người, kể cả các vận động viên nổi tiếng như ngôi sao hockey Wayne Gretzky, Hank Aaron vĩ đại của bóng chày và vô địch Olympic mười môn phối hợp Bruce Jenner đều bị tàn tật bởi bệnh viêm khớp. Cho tới gần đây, các bác sĩ vẫn kê đơn Aspirin cho bệnh nhân để làm dịu sự sưng tấy gây nhức nhối kinh niên ở các khớp viêm. Hàng nghìn năm nay, các thầy thuốc ở các nền văn hóa khác nhau đã biết rằng vỏ cây liễu có tính kháng viêm làm giảm đau và sưng tấy. Vào năm 1829, các nhà hóa học người Đức đã tách được thành phần có hoạt tính trong vỏ cây liễu, và sau này trong thế kỷ đó các nhà hóa học khác đã hiệu chỉnh hóa học nó để tạo ra một dược chất còn hiệu quả hơn-chính là aspirin. Mặc dù loại thuốc này vẫn có tác dụng, nó có một số tác dụng phụ không tốt như gây đau rát ở dạ dày và làm giảm khả năng đông máu.
Chỉ khi các nhà hóa sinh học phát hiện ra cơ chế hoạt động của aspirin thì các tác dụng có lợi và các tác dụng không mong muốn của nó mới có thể được giải thích. Họ khám phá ra rằng aspirin gắn kết với một amino acid đặc thù (Serine) ở một protein gọi là Cyclooxygenase, hay COX và gắn vào amino acid này một nhóm Acetyl. Chức năng bình thường của COX trong cơ thể là hoạt động như một enzyme: một chất xúc tác để đẩy nhanh sự chuyển biến một acid béo mạch thẳng thành cấu trúc vòng. Phân tử acid béo đi vào một đường ống trên đại phân tử enzyme, nơi nó trải qua một biến đổi hóa học đặc hiệu, sau đó rời khỏi enzyme. Dạng vòng của acid béo này kích thích hiện tượng viêm ở khớp, sữa chữa các vết thương ở dạ dày và giúp đông máu. Khi serine ở COX bị acetyl hóa bởi phản ứng với aspirin, enzyme không còn đẩy nhanh sự sản xuất cấu trúc vòng nữa. Không có COX sự tạo thành cấu trúc vòng vẫn xảy ra nhưng ở tốc độ rất chậm. Vì vậy khi COX bị ức chế bởi Aspirin, hiện tượng viêm khớp được giảm nhẹ, nhưng kèm theo là sự hủy hoại dạ dày và sự giảm đông máu.
Quá trình tìm kiếm tiếp tục để tìm ra một loại thuốc chống viêm "tốt hơn": một loại thuốc chỉ ngăn chặn COX ở khớp. Trong những năm của thập kỷ 90, các nhà hóa sinh đã tình cờ thành công. Họ phát hiện ra rằng thực ra có hai loại enzyme COX, một loại tác động vào dạ dày và các tế bào máu (COX-1) và một loại khác tác động vào khớp (COX-2). Khi họ xác định trình tự của hai enzyme này, họ phát hiện ra rằng chúng chỉ khác nhau ở một amino acid: COX-1 có một Isoleucine to lớn tại vị trí Valine nhỏ hơn của COX-2. Valine ở COX-2 làm lộ ra một đường ống bên hông đại phân tử enzyme trong khi đường ống này bị bịt bởi Isoleucine ở COX-1.
Các nhà sinh hóa sử dụng kiến thức về thành phần protein và cấu trúc để thiết kế ra các phân tử nhầm mục đích ngăn chặn một cách đặc hiệu đường ống COX-2 mà không có ảnh hưởng gì đến COX-1. Những loại thuốc mới (celecoxib và rofecoxib) làm dịu các triệu chứng viêm khớp mà không gây tác dụng phụ đến dạ dày và máu. Sự phát triển nhanh chóng của các loại thuốc trên đại diện cho một nghiên cứu điển hình trong quá trình thiết kế tân dược: ngăn chặn một sự chuyển biến hóa học cụ thể trong tế bào bằng cách ngăn chặn enzyme đặc hiệu xúc tác cho nó.
Hàng ngàn các phản ứng có xúc tác enzyme xảy ra mọi lúc ở mọi cơ thể sinh vật, mỗi phản ứng được xúc tác bởi một protein đặc hiệu có cấu trúc ba chiều đặc thù. Cùng với nhau các phản ứng này tạo nên quá trình chuyển hóa, chính là toàn bộ các hoạt động hóa học của một cơ thể sống; ở bất kỳ thời điểm nào quá trình chuyển hóa đều gồm có hàng nghìn các phản ứng hóa học riêng rẽ. Nhiều phản ứng chuyển hóa có thể được phân loại là phản ứng xây đắp sự phức tạp trong tế bào, sử dụng năng lượng để làm điều đó, hoặc phân hủy các chất phức tạp thành các chất đơn giản hơn và giải phóng năng lượng trong quá trình đó.
Chương này quan tâm đến năng lượng và các enzyme. Nếu không có chúng, cả chúng ta lẫn các sinh vật khác sẽ không có khả năng thực hiện các chức năng. Trước khi tìm hiểu enzyme thực hiện ma thuật phân tử như thế nào chúng ta sẽ xem xét các nguyên lý chung về năng lượng trong các hệ sinh học.
Năng lượng và sự chuyển đổi năng lượng[sửa]
Các nhà vật lý định nghĩa năng lượng là khả năng sinh công, xảy ra khi một lực tác động vào một vật trên một khoảng cách nào đó. Trong hóa sinh sẽ thuận lợi hơn nếu ta xem năng lượng là khả năng thay đổi. Không có tế bào nào tạo ra năng lượng cả-mọi sinh vật sống phải thu lấy năng lượng từ môi trường. Thực ra một trong những định luật cơ bản của vật lý là năng lượng không thể được tạo ra hay bị phá hủy. Tuy nhiên năng lượng có thể chuyển đổi từ dạng này sang dạng khác và các tế bào sống thực hiện rất nhiều những chuyển đổi năng lượng như vậy. Các quá trình chuyển đổi năng lượng được liên kết với các chuyển đổi hóa học xảy ra trong tế bào-như sự phá vỡ các liên kết hóa học, sự chuyển động của các chất qua màng...v.v.
Biến đổi năng lượng liên quan đến biến đổi vật chất[sửa]
Năng lượng tồn tại dưới nhiều dạng: hoá năng, quang năng và cơ năng, nhưng tất cả các dạng này có thể được xếp thành 2 dạng cơ bản :
- Động năng gắn với sự chuyển rời vị trí các vật. Động năng phụ thuộc vào sự thay đổi vị trí và trạng thái của vật .Nó có thể tồn tại ở dạng năng lượng nhiệt, điện năng, cơ năng, quang năng, hay các dạng năng lượng khác.
- Thế năng gắn với trạng thái và vị trí của vật mang năng lượng . Nó có thể tồn tại trong các liên kết hoá học, như sự chênh lệch nồng độ hay điện thế, hay những dạng khác.
Nước bị ngăn trong các đập có thế năng. Khi nước được xả ra từ các đập phần thế năng của chúng chuyển thành dạng động năng, phần năng lượng này được khai thác để sản xuất điện năng phục vụ sản xuất và đời sống.(hình 6.1). Tương tự như vậy axit béo chứa năng lượng hoá học trong trong các liên kết C – H và liên kết C – C của chúng. Năng lượng này có thể được giải phóng để thực hiện công hoá sinh.
Trong tất cả các tế bào sinh vật xuất hiện 2 loại phản ứng chuyển hoá:
- Quá trình đồng hoá (sự đồng hoá ) liên kết các phân tử đơn giản hình thành các các phân tử phức tạp hơn. Quá trình tổng hợp Protein từ các axitamin là 1quá trình đồng hoá. Quá trình đồng hoá là quá trình tích luỹ năng lượng từ các các liên kết hoá học đã hình thành.
- Quá trình dị hoá (sự dị hoá) phá vỡ các đại phân tử phức tạp thành các phân tử đơn giản và giải phóng năng lượng. tích luỹ trong các liên kết hoá học. Đông hoá và dị hoá thường diễn ra song song với nhau. Năng lượng được giải phóng trong quá trình dị hoá đựoc sử dụng để đồng hoá tức là thực hiện công sinh học. Các hoạt động của tế bào : phát triển, di chuyển và vận chuyển các ion qua màng… đều cần đến năng lượng, không có quá trình nào được thực hiện mà không cần được cung cấp năng lượng . Trong phần tiếp theo chúng ta sẽ xem xét các định luật chi phối quá trình chuyển hoá năng lượng, tìm ra năng lượng sẵn có cho quá trình thực hiện công sinh học và xem xét chiều truyền năng lượng.
ĐỊNH LUẬT THỨ NHẤT: NĂNG LƯỢNG KHÔNG TỰ NHIÊN SINH RA CŨNG KHÔNG TỰ NHIÊN MẤT ĐI[sửa]
Năng lượng có thể được chuyển từ dạng này sang dạng khác. Ví dụ bằng cách đánh que diêm ta đã biến hóa thế năng thành ánh sáng và nhiệt. Định luật thứ nhất của nhiệt động học nói rằng trong bất kỳ biến đổi năng lượng nào như vậy, năng lượng không sinh ra cũng không bị phá huỷ.
Định luật một cho chúng ta biết rằng trong bất kỳ biến đổi năng lượng từ dạng này sang dạng khác, tổng năng lượng trước và sau biến đổi là như nhau (hình 6.2a). Như ta sẽ thấy ở hai chương tiếp theo, hóa thế năng trong các liên kết hóa học của các carbohydrate và lipid có thể được chuyển thành thế năng ở dạng ATP. Năng lượng này sau đó có thể được sử dụng để tạo thế năng ở dạng gradient nồng độ thiết lập bởi vận chuyển chủ động, và có thể được chuyển thành động năng để thực hiện công cơ học, ví dụ co cơ.
Không phải tất cả các năng lượng có thể sử dụng và hỗn loạn có xu thế tăng[sửa]
Định luật hai của nhiệt động học nói rằng mặc dù năng lượng không thể được tạo ra hay phá huỷ, khi năng lượng được chuyển từ dạng này sang dạng khác thì một số năng lượng trở thành dạng không có khả năng sinh công (Hình 6.2b). Nói cách khác, không có quá trình vật lý hay hóa học nào là hiệu suất 100% cả và không phải tất cả năng lượng giải phóng đều có thể chuyển thành công. Một số năng lượng bị lấy đi vào dạng liên quan đến sự hỗn loạn. Định luật hai đúng cho tất cả các biến đổi năng lượng nhưng ở đây chúng ta sẽ tập trung vào các phản ứng hóa học trong tế bào sống.
KHÔNG PHẢI TẤT CẢ NĂNG LƯỢNG ĐỀU DÙNG ĐƯỢC
Trong bất kỳ hệ nào, tổng năng lượng bao gồm năng lượng sử dụng được có thể sinh công và năng lượng không sử dụng được mất đi vào sự hỗn loạn:
Trong các hệ sinh học, tổng năng lượng được gọi là enthalpy (H). Năng lượng sử dụng được có khả năng sinh công gọi là năng lượng tự do (G). Năng lượng tự do là những gì tế bào đòi hỏi cho mọi phản ứng hóa học trong sinh trưởng tế bào, phân bào và duy trì trạng thái khỏe mạnh của tế bào. Năng lượng không sử dụng được được biểu diễn bởi entropy (S), là đại lượng đo độ hỗn loạn của hệ thống, nhân với nhiệt độ tuyệt đối (T). Vì vậy chúng ta có thể viết lại phương trình chữ trên một cách chính xác hơn là
Vì chúng ta quan tâm đến năng lượng sử dụng được, chúng ta biến đổi biểu thức trên thành:
Mặc dù chúng ta không thể đo G, H hay S một cách tuyệt đối, chúng ta có thể xác định sự biến đổi của mỗi đại lượng ở nhiệt độ không đổi. Những biến đổi năng lượng này được đo bằng calories (cal) hoặc joules (J)(Xem chương 2). Đại lượng biến đổi trong năng lượng được biễu diễn bằng chữ delta (Δ)
Giá trị của đại lượng biến đổi có thể âm hoặc dương.
Ở nhiệt độ không đổi, ΔG được định nghĩa theo sự biến đổi của năng lượng tổng số và sự biến đổi của entropy (Δ):
Phương trình này nói cho ta biết năng lượng được giải phóng hay tiêu thụ bởi một phản ứng hóa học:
- Nếu ΔG âm (ΔG < 0) năng lượng được giải phóng
- Nếu ΔG dương (ΔG > 0) phản ứng đòi hỏi năng lượng (tiêu thụ).
Nếu năng lượng tự do không có sẵn thì phản ứng sẽ không tự xẩy ra
Dấu và độ lớn của ΔG phụ thuộc vào hai đại lượng bên phải của phương trình:
- ΔH: trong một phản ứng ΔH là tổng năng lượng thêm vào phản ứng (ΔH > 0) hoặc giải phóng (ΔH <0).
- ΔS: Phụ thuộc vào dấu và độ lớn của ΔS, đại lượng TΔS có thể âm hoặc dương, lớn hoặc nhỏ. Nói các khác trong các hệ thống sống ở nhiệt độ không đổi (T không đổi), độ lớn và dấu của ΔG có thể phụ thuộc rất nhiều vào entropy. Biến đổi lớn về entropy làm cho ΔG âm hơn như đã cho thấy bằng dấu trừ ở trước thừa số TΔS.
Nếu một phản ứng hóa học tăng entropy thì sản phẩm của nó sẽ hỗn loạn hơn chất tham gia phản ứng. Nếu có nhiều sản phẩm hơn chất tham gia phản ứng như trong phản ứng thủy phân của một protein thành các amino acid, các sản phẩm có khá nhiều tự do để có thể chuyển động xung quanh. Độ hỗn loạn của một dung dịch amino acid sẽ lớn hơn so với độ hỗn loạn của protein trong đó các liên kết peptide và các lực khác ngăn cản sự chuyển động tự do. Vì vậy trong phản ứng thủy phân thay đổi về entropy (ΔS) sẽ dương.
Nếu có ít sản phẩm hơn và chúng bị hạn chế chuyển động hơn so với chất tham gia phản ứng thì ΔS sẽ âm. Ví dụ một protein lớn liên kết bởi các liên kết peptide ít có tự do trong di chuyển hơn một dung dịch của hàng trăm hay hàng ngàn amino acid tổng hợp nên nó.
Độ hỗn loạn có xu thế tăng
Định luật thứ hai của nhiệt động học cũng dự đoán rằng, độ hỗn loạn có xu hướng tăng như một hệ quả của sự chuyển đổi năng lượng. Biến đổi hóa học, vật lý và các quá trình sinh học tất cả đều có xu hướng tăng entropy và vì vậy có xu hướng đi đến hỗn loạn (Hình 6.2b). Xu hướng đi đến hỗn loạn này cho ta chiều hướng xảy ra của một quá trình vật lý hoặc hóa học. Nó giải thích tại sao một số phản ứng xảy ra theo một chiều nào đó mà không phải chiều khác.
Định luật hai áp dụng như thế nào đối với các sinh vật? Lấy cơ thể con người với các cấu trúc có độ phức tạp cao được tạo nên từ những phân tử đơn giản. Sự tăng về độ phức tạp rõ ràng trái với định luật hai. Nhưng điều này không phải như ta nghĩ! Tạo nên một 1 kg cơ thể con người đòi hỏi 10 kg vật liệu sinh học được chuyển hóa và trong quá trình đó chúng được chuyển thành CO2, H2O và các phân tử đơn giản hơn và các biến đổi này đòi hỏi rất nhiều năng lượng. Quá trình chuyển hóa này tạo ra nhiều hỗn loạn hơn trật tự trong 1 kg cơ thể. Sự sống đòi hỏi sự nạp năng lượng thường xuyên để duy trì trật tự. Không có sự trái ngược nào với định luật hai của nhiệt động học cả.
Sau khi đã thấy các định luật vật lý về năng lượng áp dụng cho các sinh vật sống, chúng ta sẽ chuyển sang xem xét các định luật này áp dụng cho các phản ứng hóa học như thế nào.
Các phản ứng hóa học giải phóng hoặc hấp thu năng lượng[sửa]
Trong tế bào các phản ứng đồng hóa có thể chỉ tạo nên một sản phẩm duy nhất, ví dụ protein (một chất có mức trật tự cao) từ nhiều chất tham gia nhỏ hơn, ví dụ amino acid (mức độ cấu trúc thấp hơn). Những phản ứng như vậy đòi hỏi, tức tiêu thụ năng lượng. Các phản ứng dị hóa có thể phá vỡ một chất tham gia có trật tự, như phân tử glucose, thành những những sản phẩm phân tán một cách ngẫu nhiên hơn như carbon dioxide và nước. Những phản ứng như vậy giải phóng năng lượng. Nói cách khác một số phản ứng giải phóng năng lượng tự do và một số khác tiêu thụ.
Lượng năng lượng giải phóng (-ΔG) hay tiêu thụ (+ΔG) bởi một phản ứng liên quan trực tiếp đến xu hướng của một phản ứng đi đến tận cùng (điểm mà tại đó tất cả chất tham gia được chuyển thành sản phẩm):
- Một số phản ứng có xu hướng đi đến tận cùng mà không cần năng lượng. Những phản ứng này giải phóng năng lượng và được gọi là phản ứng giải năng và có ΔG âm (Hình 6.3a).
- Các phản ứng đi đến tận cùng chỉ khi thêm năng lượng tự do từ môi trường là các phản ứng thu năng và có ΔG dương (Hình 6.3b).
Nếu một phản ứng giải phóng năng lượng khi diễn ra theo một chiều (ví dụ từ chất tham gia A thành sản phẩm B) thì phản ứng ngược lại (B thành A) đòi hỏi sự cung cấp năng lượng liên tục để có thể xảy ra. Nếu A --> B là tỏa năng (ΔG<0) thì B-->A là thu năng (ΔG>0).
Về nguyên tắc các phản ứng hóa học có thể xảy ra theo hai chiều thuận và nghịch. Ví dụ nếu hợp chất A có thể chuyển thành hợp chất B (A-->B) thì về nguyên tắc B có thể được chuyển thành A (B-->A) và chỉ một trong hai chiều phản ứng sẽ được ưu tiên. Hãy coi một phản ứng tổng cộng là kết quả từ sự cạnh tranh giữa các phản ứng thuận và phản ứng nghịch (A<=>B). Tăng nồng độ của chất tham gia (A) làm tăng tốc độ phản ứng thuận, và tăng nồng độ của sản phẩm (B)tạo thuận lợi cho phản ứng nghịch. Ở một nồng độ nào đó của A và B các phản ứng thuận và nghịch diễn ra ở cùng tốc độ. Ở nồng độ này tổng biến đổi trong hệ thống bằng không mặc dù từng phân tử vẫn hình thành hoặc phân huỷ. Sự cân bằng giữa các phản ứng thuận và nghịch này được biết dưới tên gọi cân bằng hóa học. Cân bằng hóa học là một trạng thái cân bằng tĩnh, một trạng thái không có sự thay đổi và là một trạng thái trong đó ΔG = 0.
Cân bằng hóa học và năng lượng tự do có liên quan đến nhau[sửa]
Mọi phản ứng hóa học đều xảy ra đến một mức độ nào đó, nhưng không nhất thiết đến
ATP: Transferring energy in cells[sửa]
ATP: QUÁ TRÌNH TRAO ĐỔI NĂNG LƯỢNG TRONG TẾ BÀO
ATP hydrolysis releases energy[sửa]
THỦY PHÂN ATP GIẢI PHÓNG NĂNG LƯỢNG
ATP couples exergonic and endergonic reactions[sửa]
ATP ĐI KÈM THEO CÁC PHẢN ỨNG GIẢI PHÓNG VÀ THU NĂNG LƯỢNG
Enzyme chất xúc tác sinh học[sửa]
Khi chúng ta biết được năng lượng tự do của phản ứng thì chúng ta sẽ biết được điểm cân bằng của phản ứng, điểm mà tại đó năng lượng tự do của phản ứng nhỏ hơn không và phản ứng không diễn ra nữa. Tuy nhiên năng lượng tự do thì không cho chúng ta biết tốc độ của phản ứng, nó chỉ cho chúng ta biết sự thay đổi của điểm cân bằng của phản ứng khi có sự thay đổi của năng lượng tự do. Những phản ứng nếu cứ theo các cách thông thường xẩy ra trong cơ thể thì chúng sẽ điễn ra quá chậm để chúng có thể dóng góp cho sự sống, trừ khi trong tế bào có cơ chế làm tăng tốc độ phản ứng của chúng. Đó là vai trò của các chất xúc tác, chúng làm tăng tốc độ của phản ứng mà không làm thay đổi bản chất của phản ứng. Chất xúc tác không làm thay đổi kết quả của phản ứng, mà chỉ lam thay đổi tốc độ của phản ứng theo cả hai chiều thuận và nghịch. Theo đó phản ứng sẽ tiếp cận điểm cân bằng nhanh hơn.
Một chất xúc tác quan trọng phải kể đến đó là các protein chúng được gọi là các enzyme. mặc dù phần lớn các enzyme là protein nhưng vẫn có một vài loại có bản chất không phải là protein. Chúng có thể là các ribozime có bản chất là các ARN. Có thể trong nguồn gốc phát triển của các chất xúc tác, nó không chỉ có bản chất là protein mà còn có bản chất của nhiều chất khác như ADN chẳng hạn, nhưng trong quá trình tiến hóa đã chon protien như là một chất xúc tác chính bởi tính đa dạng cao của chúng trong cấu trúc bậc ba và sự đa dạng trong chức năng sinh học của chúng.
Chúng ta sẽ đi sâu vào tìm hiểu về năng lượng cản trở các phản ứng xẩy ra từ đó chúng ta sẽ thấy được vai trò của enzyne. Như làm thế nào mà chúng tương tác với các phản ứng, làm thế nào mà chúng hạ thấp được năng lượng phản ứng, làm thế nào mà chúng cho phép phản ứng diễn ra nhanh hơn và làm thế nào mà một enzyme có thể liên kết với cơ chất.
For a reaction to proceed an energy barrier must be overcome[sửa]
ĐỂ MỘT PHẢN ỨNG XẢY RA CẦN VƯỢT QUA ĐƯỢC RÀO CẢN NĂNG LƯỢNG
Enzyme bind specific reactant molecules[sửa]
ENZYME GẮN ĐẶC HIỆU VỚI PHÂN TỬ CHẤT THAM GIA PHẢN ỨNG
Enzyme làm giảm rào cản năng lượng nhưng không làm thay đổi điểm cân bằng của phản ứng[sửa]
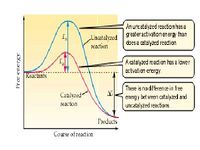
Phản ứng xẩy ra giữa enzyme và cơ chất diến ra rất phức tạp, nhưng năng luợng hoạt hóa trong phản ứng có enzyme xúc tác thì nhỏ hơn hơn nhiều so với cá phản ứng không có enzyme xúc tác( hình 611), do enzyme đã hạ thấp được năng lượng cản trở phản ứng, vì vậy nó tạo điều kiện cho phản ứng diễn ra dễ dàng hơn.
khi một enzyme làm giảm rào cản năng lượng của phản ứng thì nó làm tăng tốc độ của phản ứng theo cả hai chiều thuận và nghịch. Vì thế chất xúc tác enzyme làm cho phản ứng tới gần điểm cân bằng nhanh hơn phản ứng không có enzyme xúc tác
Hơn nữa một enzyme phản ứng không làm thay đổi năng lượng tự do của phản ứng giữa chất tham gia phản ứng và sản phảm tạo thành(hình 611). Nó không làm thay đổi hoạt động năng lượng, nhưng có ảnh hưởng đến tốc độ phản ứng. Lấy một ví dụ như sau nếu ta có 600 phân tử protein với arginine là amino acid cuối cùngtan vào dung dịch. Các phân tử protein sẽ chuyển dịch theo hướng hỗn loạn, và mạch peptid cuối cùng sẽ bị phá vỡ, giả phóng ra arginine, cứ theo cách này thì sau 7 năm một nửa luợng protein tức (300 phân tử) sẽ tham gia phản ứng. Nhứng nếu có mặt cuẩ chất xúc tác enzyme thì để phản ứng xẩy ra hết 300 phân tử protein chỉ cần mất nủa dây.
What are the chemical events at active sites of enzymes?[sửa]
NHỮNG SỰ KIỆN HÓA HỌC GÌ XẢY RA Ở CÁC VỊ TRÍ HOẠT ĐỘNG CỦA ENZYME?
cấu trúc phân tử quyết định chức năng của enzyme[sửa]
Hầu hết enzyme (và cả các riobozyme) đều có kích thước lớn hơn nhiều so với cơ chất của chúng. Enzyme thông thường là một protein chứa hàng trăm axit amin, và có thể được tạo nên từ một chuỗi polypeptide duy nhất hoặc nhiều tiểu đơn vị (nhiều chuỗi). Còn cơ chất của chúng thường là một phân tử nhỏ, Trung tâm hoạt động của enzyme thường khá nhỏ, chứa không nhiều hơn 6-12 axit amin. Hai câu hỏi nảy sinh từ quan sát này:
- Tính chất gì làm cho trung tâm hoạt động của enzyme có thể nhận biết và kết hợp với cơ chất?
- Vai trò của phần protein rất lớn còn lại?
TRUNG TÂM HOẠT ĐỘNG CÓ TÍNH ĐẶC HIỆU VỚI CƠ CHẤT[sửa]
Khả năng phi thường của enzyme để chọn đúng chính xác loại cơ chất phụ thuộc vào sự khớp nhau một cách chính xác về hình dạng phân tử và các tương tác của các nhóm hoá học ở vị trí liên kết. Sự kết hợp cơ chất vào trung tâm hoạt động cũng phụ thuộc vào cùng các lực duy trì cấu trúc bậc 4 của enzyme: lực liên kết hydrogen, lực hút và đẩy các nhóm tích điện, và cả tương tác kị nước. Năm 1894, nhà hoá học người Đức Emil Fischer đã so sánh tính vừa khớp của enzyme và cơ chất giống như sự khớp nhau của ổ khoá và chìa khoá. Mô hình của Fischer tồn tại hơn nửa thế kỷ chỉ với các sự chứng minh gián tiếp. Bằng chứng trực tiếp đầu tiên xuất hiện vào năm 1965 khi David Phillips và các cộng sự của ông ở học việc Royal Lodon đã thành công trong việc kết tinh enzyme lysozyme và xác định cấu trúc bậc 4 của nó khi sử dụng kĩ thuật kết tinh nhờ tia X (sẽ được miêu tả trong chương 11). Họ quan sát thấy một cấu trúc lõm trên lysozyme có hình dạng vừa khớp với cơ chất của nó. (hình 6.13)
Enzyme thay đổi cấu hình không gian khi gắn với cơ chất[sửa]
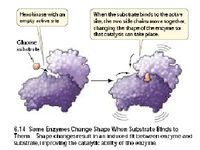
Vì là một protein nên cấu trúc enzyme không phải là không biến đổi. Giống như là cấu trúc protein lòng trắng trứng thay đổi khi trứng bị đun nóng, rất nhiều enzyme thay đổi cấu trúc của nó (mặc dù ở mức độ nhỏ hơn) khi nó kết hợp với cơ chất. Sự thay đổi hình dạng đó làm lộ ra vùng trung tâm hoạt động của enzyme, phần sẽ phản ứng với cơ chất. Sự thay đổi hình dạng đó của enzyme do kết hợp với cơ chất được gọi là sự vừa khớp hình dạng do cảm ứng.
Sự vừa khớp cảm ứng này có thể quan sát thấy ở enzyme hexokinase (hình 6.14) khi nó được nghiên cứu trong điều kiện có mặt và không có mặt cơ chất-glucose (một cơ chất khác của nó là ATP). Nó xúc tác phản ứng :
Sự vừa khớp cảm ứng mang các chuỗi bên hoạt dộng của trung tâm hoạt động của enzyme vào các vị trí sóng đôi với cơ chất, tạo điều kiện cho cơ chế xúc tác đã mô tả ở trên diễn ra dễ dàng hơn (hình 6.12). Một điều không kém quan trọng là sự gập của hexokinase để kết hợp với cơ chất glucose khiến nước không thể đi vào trung tâm hoạt động. Điều đó là cần thiết bởi vì 2 cơ chất kết hợp với enzyme là glucose và ATP, nếu nước có mặt thì ATP có thể bị thủy phân thành ADP và phosphate. Nhưng vì nước không có mặt nên sự chuyển P từ ATP sang glucose được ưu tiên. Sự khớp cảm ứng ít nhất cũng giải thích một phần về nguyên nhân enzyme có kích thước lớn. Phần phân tử lượng lớn có thể đóng 2 vai trò sau:
- nó cung cấp một khung (giá) cấu trúc để các axit amin của trung tâm hoạt động được bố trí một cách phù hợp đối với cơ chất.
- nó tham gia vào những biến đổi nhỏ nhưng có ý nghĩa trong hình dạng và cấu trúc của protein, tạo nên sự khớp cảm ứng.
Một số enzyme cần các phân tử khác để có thể hoạt động[sửa]
Mặc dù có kích thước lớn và phức tạp nhưng rất nhiều enzyme phải có sự hiện diện của các phân tử không protein khác để có thể thưc hiện chức năng của mình. Một số phân tử "đối tác" đó gồm có:
- cofactor (đồng nhân tố): đó là các ion vô cơ như đồng kẽm hoặc sắt kết hợp với một số enzmye và quyết định bản chất của enzyme.
- Coenzyme: các phân tử chứa cácbon này cần cho hoạt động của một hoặc nhiều enzyme. Coenzyme thường tương đối nhỏ so với enzyme mà chúng thường kết hợp tạm thời hình 6.15)
- Các nhóm bộ phận giả (chân giả, tay giả, mắt giả): Những nhóm phân tử khác biệt này gắn kết vĩnh viễn với enzyme. Chúng bao gồm các nhóm heme được gắn vào protein vận chuyển oxy,heamoglobin (cho thấy ở hình 3.8).
Coenzyme giống như các cơ chất không gắn cố định với enzyme, và cần tiếp xúc với enzyme và kết hợp vào trung tâm hoạt động. Một coenzyme có thể được coi là một cơ chất bởi vì nó thay đổi tính chất hoá học trong khi phản ứng xáy ra và tách biệt với enzyme để tham gia vào phản ứng kháC.
Các coenzyme di chuyển từ phân tử enzyme này sang phân tử enzyme khác, kết hợp hoặc di chuyển các nhóm hoá học từ cơ chất. ATP và ADP có thể được coi như là các coenzyme bởi vì chúng cần thiết cho một số phản ứng, bị thay đổi trong phản ứng, kết hợp hoặc tách khỏi enzyme. Trong chương tiếp theo, chúng ta sẽ bắt gặp coenzyme với chức năng trong quá trình chuyển hoá năng lượng bằng việc nhận hay cho các electron và nguyên tử H. Đối với các loài động vật, một vài coenzyme được tạo ra từ các vitamin cần phải có trong sản phẩm thức ăn mà cơ thể không tự tổng hơp được. Ví dụ, vitamin B niacin được sử dụng để tạo ra coenzyme NAD.
Nồng độ cơ chất ảnh hưởng đến tốc độ phản ứng[sửa]
Với một phản ứng thuộc loại A --> B, tốc độ của phản ứng không xúc tác thì tỉ lệ với nồng độ của chất A (hình 6.16). Nồng độ của cơ chất càng cao thì càng có nhiều phản ứng xảy ra trong một phút. Một lượng enzyme thích hợp làm tăng tốc độ của phản ứng, dĩ nhiên điều đó cũng làm thay đổi hình dạng của đồ thị tốc độ phản ứng/nồng độ cơ chất. Ban tiên, tốc độ của phản ứng có enzyme xúc tác tăng khi nồng độ cơ chất tăng, nhưng sau đó nó sẽ không đổi. Khi việc tăng thêm nồng độ cơ chất không làm thay đổi đáng kể tốc độ phản ứng thì phản ứng đã đạt tới tốc độ cực đại. Vì nồng độ của enzyme thường nhỏ hơn nồng độ cơ chất của nó, những gì mà chúng ta đang thấy là hiện tượng bão hoà giống như cái xảy ra ở khuyếch tán chủ động (xem chương 5). Khi mà tất cả các phân tử enzyme đã kết hợp với cơ chất, thì chúng sẽ hoạt động nhanh nhất ở điểm cực đại của tốc độ phản ứng. Do đó không có ích gì nếu ta tăng nồng độ của cơ chất, bởi vì không phân tử enzyme nào còn tự do để tham gia phản ứng xúc tác.
Quá trình chuyển hóa và sự điều hòa của enzyme[sửa]
Đặc tính của sự sống là sự cân bằng,sự duy trì điều kiện bên trong.Sự điều khiển bởi nhiều enzym khác nhau.Nó được điều khiển bằng hàng ngàn enzym khác nhau để duy trì nội cân bằng.Trong phần còn lại của chương này chúng ta sẽ nghiên cứu vai trò của enzym trong tổ chức và điều khiển quá trình trao đổi chất.Trong điều kiện tế bào sự hoạt động của enzym có thể được hoạt hóa hoặc ức chế bằng nhiều cách, vì vậy sự có mặt của enzym không nhất thiết đảm bảo nó hoạt động. Có một số quá trình chuyển hóa sẽ thay đổi nếu có một vài enzym xúc tác, chính enzym sẽ điều khiển quá trình chuyển hóa. Phần cuối chúng ta nghiên cứu ảnh hưởng của pH, nhiệt độ, các chất từ môi trường lên hoạt độ enzym.
Metabolism is organized into pathways[sửa]
QUÁ TRÌNH CHUYỂN HÓA ĐƯỢC TỔ CHỨC THÀNH CÁC CON ĐƯỜNG CHUYỂN HÓA
Quá trình chuyển hóa được tổ chức bằng nhiều con đường Sự trao đổi chất của một cơ thể sinh vật là tổng hợp tất cả các phản ứng hóa sinh trong phạm vi cơ thể.Trao đổi chất làm thay đổi thức ăn và dự trữ năng lượng để duy trì sự sống của tế bào.Trao đổi chất là do nhiều chuỗi phản ứng với xúc tác là các enzym.Trong chuỗi thì sản phẩm của một phản ứng sẽ là cơ chất cho phản ứng tiếp theo.
Sự đồng hóa một số chất, tổng hợp các chất hữu cơ xây dựng cơ thể. Quá trình dị hóa phân giải để giải phóng năng lượng,tạo các chất có trọng lượng phân tử nhỏ, hoặc ức chế các chất độc. Sự cân bằng bao gồm đồng hóa và dị hóa, chúng có thể thay đổi tùy theo nhu cầu của tế bào.Vì vậy trong tế bào cần phải điều khiển các quá trình chuyển hóa một cách liên tục.
Enzyme activity is subject to regulation by inhibitors[sửa]
HOẠT TÍNH CỦA ENZYME BỊ ĐIỀU HÒA BỞI CÁC CHẤT ỨC CHẾ
CÁC ENZYME BIẾN CẤU ĐIỀU KHIỂN HOẠT TÍNH CỦA CHÚNG BẰNG CÁCH THAY ĐỔI CẤU HÌNH[sửa]
Hoạt độ của enzym được điều khiển bằng chất ức chế Các chất ức chế khác nhau có thể liên kết với enzym, làm chậm tốc độ của phản ứng. Một vài chất ức chế có sẵn trong tế bào, một số khác do từ bên ngoài. Các chất ức chế có sắn trong tế bào thì điều khiển quá trình chuyển hóa, còn từ bên ngoài thì có thể do điều trị bệnh.Có một vài chất ức chế enzym băang cách gắn vào nó.Một vài hiệu quả do chúng tạo ra tức là chúng có thể trở thành tự do.Sự chuyển hóa có sự tham gia của nhữngchất có sẵn trong tế bào làm tăng tốc độ phản ứng enzym.
Chất ức chế không thuận nghịch
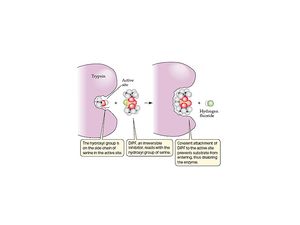
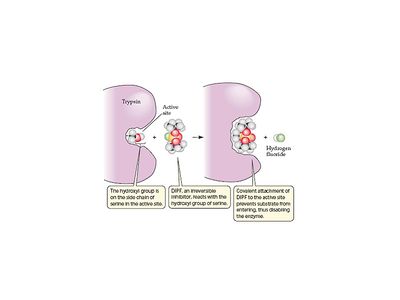
Một số chất ức chế liên kết với enzym tại trung tâm hoạt động, nó sẽ liên tục ức chế hoạt động của enzym . Ở phần đầu của chương chúng tôi đã mô tả Aspirin, một chất có nhóm acetyl ảnh hưởng tới serine tại vị trí hoạt động của cylooxydase, ngăn cản serin tham gia xúc tác. Một vài ví dụ về chất ức chế không thuận nghịch làDIPF, nó cũng phản ứng với serin. DIPF là chất ức chế của enzym acetylcholinase, một enzym cần thiết cho truyền xung đông thần kinh của tế bào thần kinh đến tế bào khác.Bởi vì ảnh hưởng của DIPF đến acetylcholinase.DIPF và các chất tương tự như nó đã được phân loại goi là gây độc thần kinh. Một trong số chúng là Sarin, đã được sử dụng trong tấn công đường ngầm TOKYO 1995. Việc sử dụng rông rãi thuốc trừ sâu malathion, là dẫn xuất của DIPF mà nó sẽ ức chế acetylcholinase của côn trùng, chứ không phải enzym mammalian.
Chất ức chế thuận nghịch Không phải tất cả các chất ức chế đều là không thuận nghịch. Một vài chất ức chế liên kết không đồng hóa trị tại trung tâm hoạt động chưa đủ làm thay đổi trung tâm hoạt động.Trong khi có một chất có trong trung tâm hoạt động thì cơ chất không thể vào trung tâm hoạt động. Vì vậy chất ức chế kéo dài thời gian hoạt động của enzym, ngăn cản phản ứng xảy ra. Chất đó gọi là ức chế thuận nghịch. Bởi vì chúng cạnh tranh với cơ chất tại trung tâm hoạt động.Khi nồng độ các chất ức chế giảm xuống, nó sẽ bị loại khỏi trung tâm hoạt động , khi đó enzym hoạt động trở lại.
Enzymsuccunate dehydrogenase là một chất ức chế thuận nghịch.Enzym này được tìm thấy ở ty thể, xúc tác chuyển hóa succinate thành fumarate.Chất ức chế thứ 3, oxaloacetat tương tự như succinate.(thiue).Một enzym không thể gắn succinate cho đến khi oxaloacetat ra khỏi trung tâm hoạt động của enzym, nó có thể xuất hiện nhiều cơ chất thêm vào. Một vài chất ức chế không kết hợp với trung tâm hoạt động của enzym gọi là chất ức chế không cạnh tranh. Chất ức chế không cạnh trạnh chỉ liên kết tại một vị trí trong trung tâm hoạt động.Liên kết của chúng là thích hợp với enzym bằng cách thay đổi trung tâm hoạt động của enzym.Trong trường hợp này cơ chất vẫn liên kết với trung tâm hoạt động nhưng tốc độ tạo sản phẩm giảm xuống.Chất ức chế không cạnh tranh giống chất ức chế cạnh trạnh, chúng có những mặt tích cực.
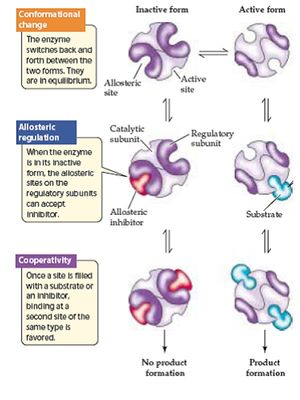
Allosteric effects regulate metabolism[sửa]
CÁC HIỆU ỨNG BIẾN CẤU ĐIỀU HÒA QUÁ TRÌNH CHUYỂN HOÁ
Enzymes are affected by their environment[sửa]
ENZYME BỊ TÁC ĐỘNG BỞI MÔI TRƯỜNG Các enzyme cho phép các tế bào thực hiện các phản ứng hóa học và tiến hành các quá trinh phức hợp một c1ch nhanh chóng mà không cần các tác nhân như nhiệt độ và nồng độ pH trong phòng thí nghiệm. Tuy nhiên, do có ba loại cấu trúc thứ nguyên cà tính chất hóa học của emzyme nên nó có độ nhạy rất cao đối với nhiệt độ và nồng độ pH. Chúng ta đã nói rõ về các ảnh hưởng thông thường của các nhân tố môi trường lên protein trong chương 3. Bây giờ chúng ta sẽ kiễm tra ảnh hửong của chúng đến chức năng của enzyme tức nhiện là dực vào cấu trúc là tính chất hóa học của enzyme. Ảnh hưởng của pH lên hoạt tính của enzyme Ảnh hưởng của nhiệt độ lên hoạt tính của enzyme