Các thuốc sử dụng phối hợp trong thở máy sơ sinh
BS. Võ Đức Minh
Mục lục
CÁC THUỐC AN THẦN VÀ GIẢM ĐAU[sửa]
Morphine[sửa]
Morphine là một ankaloit thuốc phiện nổi tiếng có các tác dụng chính trên hệ thần kinh trung ương và các cơ quan chứa cơ trơn như là đường tiêu hóa và đường tiết niệu. Cơ chế tác dụng giảm đau của thuốc là sự kích thích các receptor opiate trong hệ thần kinh bắt chước các tác dụng của các endorphin tự nhiên. An thần, giảm đau, ức chế hô hấp và giảm nhiệt độ cơ thể được tạo ra khi chỉ định morphine theo các liều quy ước. Ức chế hô hấp do các tác dụng trên các trung tâm hô hấp ở cuống não, có thể rõ rệt nhưng thường không có ý nghĩa lâm sàng ở những bệnh nhân thở máy trừ trường hợp dự kiến sẽ cai máy thở. Morphine có thể gây ra giảm sự đề kháng ngoại vi có thể không có hoặc ít ảnh hưởng đến chỉ số tim, gây hạ huyết áp, nhưng thường được chịu đựng tốt ở sơ sinh. Thường có giải phóng histamine, co thắt phế quản có thể xảy ra hoặc do phản ứng đặc ứng hoặc do liều quá lớn. Morphine giảm nhu động dạ dày và tăng trương lực cơ vòng hậu môn và trương lực cơ trơn đường tiết niệu. Morphine được hấp thu tốt bằng mọi đường dùng, kể cả đường uống, nhưng thường được cho bằng đường tiêm ở những trẻ sơ sinh bị bệnh. Khởi phát tác dụng nhanh và đạt đỉnh khoảng 1 giờ sau khi tiêm. Thời gian tác dụng ở sơ sinh có thể 2 đến 4 giờ. Morphine được khử độc đầu tiên bằng cách kết hợp tại gan với glucuronide, sau đó được bài tiết trong nước tiểu và mật. Nửa đời bài tiết có thể đến 9 giờ ở những trẻ đẻ non. Liều thông thường của morphine sulfate ở trẻ sơ sinh là 0,05 đến 0,2 mg/kg. Khi cần có thể lặp lại liều, thường mỗi 2 đến 6 giờ. Morphine cũng có thể được cho bằng đường chuyền tỉnh mạch liên tục tốc độ 10 đến 15 µg/kg/giờ sau liều tấn công ban đầu 100 µg/kg trong giờ đầu tiên. Khi chỉ định kéo dài, sự dung nạp thuốc phát triển, cần tăng liều. Sau quá trình này, cần khuyến cáo giảm liều 10% đến 20% mỗi ngày để đề phòng sự cai thuốc. Cần phải lường trước sự ức chế hô hấp, giảm nhu động dạ dày và ứ đọng nước tiểu và xem xét điều trị cho những bệnh nhân đã điều trị morphine. Các tác dụng của morphine có thể bị đảo ngược bằng naloxone 0,1 mg/kg
| BẢNG 1. Thuốc an thần và giảm đau cho sơ sinh | |||
| Thuốc | Liều bolus* | Lặp lại liều | Liều chuyền TM |
| An thần | |||
| Lorazepam | 0,05-0,1 mg/kg | 4-12 giờ | Không khuyến cáo |
| Midazolam | 0,05-0,15 mg/kg | 2-4 giờ | 10-60 µg/kg/giờ |
| Giảm đau | |||
| Morphine | 0,05-0,2 mg/kg | 2-4 giờ | 10-15 µg/kg/giờ |
| Fentanyl | 1-4 µg/kg | 2-4 giờ | 1-2 µg/kg/giờ |
- Tiêm chậm, trên 5 phút
Fentanyl[sửa]
Fentanyl là một chất tổng hợp giống thuốc phiện đã được sử dụng cho gây mê và là một thuốc giảm đau phổ biến cho sơ sinh. Nó tác dụng mạnh hơn morphine 80 lần khi tính theo cân nặng nhưng ít có tác dụng tim mạch và ức chế hô hấp hơn. Những đặc tính sau được xem như do ít tác dụng giải phóng histamine hơn. Nó cũng được chứng tỏ ít có tác dụng phụ về tiêu hóa. Những bất lợi của fentanyl, so với morphine, bao gồm thiếu các đặc tính an thần và nguy cơ làm thành ngực kém linh động. Rất may, tác dụng này cũng như các tác dụng khác của nó có thể được đảo ngược bằng chỉ định naloxone. Fentanyl giảm phản ứng stress với phẫu thuật và ức chế một số phản xạ nhự phản xạ cảm áp (baroreflex) kiểm soát tần số tim và các receptor kích thích trên đường thở.
Fentanyl có khởi phát tác dụng nhanh; tuy nhiên, nó có thời gian tác dụng ngắn hơn so với morphine (1 đến 2 giờ). Sự dung nạp xảy ra dễ dàng hơn với fentanyl so với morphine và cách giảm liều thuốc tương như đã được mô tả cho morphine được khuyến cáo cho tất cả trẻ được điều trị nhiều ngày. Fentanyl có thể được cho định kỳ bằng bolus tĩnh mạch, 1 đến 4 µg/kg, khi cần giảm đau thời gian ngắn. Nếu tiên liệu sử dụng kéo dài, cần bắt đầu chuyền dịch tốc độ 1 đến 2 µg/kg/giờ và được tăng liều tùy theo sự giảm triệu chứng. Độ thanh thải liên quan trực tiếp với tuổi thai và trọng lượng lúc sinh, vì vậy cần điều chỉnh tốc độ chuyền dịch tùy từng cá nhân của trẻ đẻ non. Nhưng thở ít hơn nhiều khi chỉ định fentanyl chuyền tĩnh mạch so với bolus; tuy nhiên, nó có thể kéo dài thời gian thở máy và chúng ta phải biết khả năng xảy ra sự cai thuốc.
Diazepam[sửa]
Diazepam có các tác dụng giảm lo âu, gây ngủ, chống co giật và giãn cơ là đặc tính của các benzodiazepine và giống như các benzodiazepine khác, thuốc không có các đặc tính giảm đau. Diazepam được hấp thu nhanh chóng sau khi uống nhưng thất thường sau khi tiêm bắp. Nửa đời bài tiết xấp xỉ 75 giờ ở sơ sinh đẻ non và 30 giờ ở trẻ đủ tháng. Thuốc được chuyển hóa qua gan và cùng với các chất chuyển hóa của nó được bài tiết chậm qua nước tiểu. Không có mối tương quan giữa nồng độ trong plasma và đáp ứng lâm sàng. Diazepam có thể gây ức chế hô hấp, thuốc có thể thật sự giúp trẻ ổn định khi thở máy. Thuốc này có thể hữu ích như thuốc an thần có tác dụng kéo dài khi được cho bằng các liều từ 0,10 đến 0,25 mg/kg mỗi 6 giờ.
Midazolam[sửa]
Midazolam là một benzodiazepine tan được trong nước có pH acid. Thuốc có khởi phát tác dụng nhanh (5 đến 6 phút) vì với pH sinh lý thuốc có tính ái lực với mỡ. Thuốc mạnh gấp hai lần diazepam, khởi phát nhanh hơn và thời gian tác dụng ngắn hơn. Vì những lý do này, midazolam trở thành một thuốc an thần phổ biến, đặc biệt khi chuyền liên tục. Thuốc được chuyển hóa trong gan và các chất chuyển hóa được bài tiết qua nước tiểu. Tiêm nhanh có thể gây ngưng thở và giảm huyết áp, tuy nhiên, khi chuyền tĩnh mạch chậm hơn, những tác dụng phụ này ít được thông báo hơn so với diazepam. Ở bệnh nhân người lớn, midazolam có nhiều đặc tính gây quên hơn so với các benzodiazepine khác. Người ta không rõ sử dụng midazolam kéo dài có ảnh hưởng đến sự phát triển của sơ sinh không. Sử dụng thang điểm đánh giá đau ở trẻ đẻ non, các trẻ sơ sinh được điều trị bằng midazolam chịu đựng được các thủ thuật đau (như hút nội khí quản), cũng như các trẻ sơ sinh được điều trị bằng morphine và cả hai nhóm này chịu đựng được các can thiệp này tốt hơn so với các nhóm chứng không được điều trị. Tuy nhiên, trong một nghiên cứu của Anand và cộng sự, các trẻ được điều trị bằng midazolam cho thấy có tỷ lệ mắc phải các biến chứng thần kinh cao hơn (tử vong, xuất huyết não thất độ III đến IV, nhuyễn chất trắng quanh não thất), so sánh với các nhóm khác, đặc biệt là morphine. Hơn nữa, trong nhóm được điều trị bằng midazolam có thời gian nằm tại phòng săn sóc tích cực nhi sơ sinh lâu hơn có ý nghĩa thống kê so với nhóm điều trị bằng giả dược. Midazolam thường được cho bằng đường tĩnh mạch hoặc tiêm bắp với liều 0,1 mg/kg, thuốc có thể được lặp lại mỗi 2 đến 4 giờ khi cần hoặc chuyền tĩnh mạch liên tục. Độ thanh thải clearance liên quan trực tiếp đến trọng lượng lúc sinh và nên xác định liều để đạt được hiệu quả mong muốn. Ở những trẻ sơ sinh bị bệnh nặng, nửa đời bán hủy của midazolam kéo dài (6,5 đến 12 giờ) và độ thanh thải clearance bị giảm (0,07 đến 0,12 L/giờ/kg) so với những người trưởng thành khỏe mạnh hoặc những nhóm bệnh nhân nhi khác. Người ta không thể xác định được những sự khác biệt này là do tuổi, chức năng cơ quan chưa trưởng thành hoặc các con đường chuyển hóa hoặc do các bệnh lý kèm theo. Ngộ độc do quá liều thường hiếm và có khả năng biểu hiện tình trạng ngủ quá mức. Giao tiếp kém và các vận động rối loạn trương lực đã được báo cáo ở một số bệnh nhân sau 4 đến 11 ngày an thần với sự kết hợp của midazolam và fentanyl. Các triệu chứng biến mất sau khi ngưng sử dụng thuốc.
Lorazepam[sửa]
Lorazepam là một benzodiazepine có hoạt tính chống co giật và vì thuốc có ái lực với lipid nên khởi phát tác dụng nhanh. Tác dụng an thần của lorazepam thay đổi theo thời gian (3 đến 24 giờ). Thuốc được kết hợp trong gan thành một glucuronide bất hoạt được gan bài tiết. Ngưng thở, ngủ nhiều và những rối loạn vận động có thể xảy ra. Lorazepam thường được chỉ định đường tiêm với liều từ 0,05 đến 0,1 mg/kg và có thể được lặp lại mỗi 4 đến 12 giờ tùy thuộc vào tác dụng. Thuốc có thể được kết hợp với morphine hoặc fentanyl.
Chloral Hydrate[sửa]
Chloral hydrate là một thuốc an thần gây ngủ có những tác dụng tương tự như các barbiturate. Thuốc không ức chế hô hấp đáng kể; tuy nhiên, thuốc không có những đặc tính giảm đau và là một chất kích thích đường tiêu hóa. Chloral hydrate được hấp thu tốt ở đường tiêu hóa và được biến đổi thành trichloroethanol nhờ gan. Cả hai trichloroethanol và một chất chuyển hóa bất hoạt, acid tricholoacetic được kết hợp và bài tiết như glucuronide, ban đầu ở nước tiểu và một phần trong mật. Nửa đời của trichloroethanol là 9 đến 40 giờ và của acid trichloroacetic lâu hơn, độ thanh thải clearance không đánh giá được sau 6 ngày được điều trị bằng một liều duy nhất 50 mg/kg chloral hydrate. Sử dụng kéo dài và lặp lại, trichloroethanol có thể tích lủy đến nồng độ gây độc và có thể gây kích thích hệ thần kinh trung ương nghịch lý, rối loạn nhịp tim và hạ huyết áp. Acid trichloroacetic có thể thay thế vị trí các thuốc gắn protein và bilirubin ở sơ sinh. Tăng bilirubin máu trực tiếp do chloral hydrate có thể xảy ra, do đó, thuốc được sử dụng thận trọng ở trẻ vàng da. Liều 25 mg/kg mỗi 6 giờ đã được báo cáo có hiệu quả, nhưng cần thận trọng khi chỉ định kéo dài nhiều ngày. Liều lớn hơn an thần cho một lần duy nhất dường như được dung nạp tốt.
CÁC THUỐC GIÃN CƠ[sửa]
Sử dụng các thuốc giãn cơ không được chỉ định thường quy trong thông khí cơ học của sơ sinh, mặc dù việc sử dụng dường như phổ biến trong một số bệnh như là tăng áp phổi tồn tại ở trẻ sơ sinh (PPHN). Mặc dù liệt cơ có thể cải thiện oxy hóa và thông khí của những trẻ đủ tháng bị tăng áp phổi tồn tại giảm oxy máu nặng, thuốc có thể có các tác dụng phụ cho trẻ đẻ non bị bệnh màng trong. Sử dụng thông khí đồng bộ có tần số thở cao hơn tần số tự phát của bệnh nhân thường sẽ đạt được mục đích gây liệt cơ. Thuốc có thể hữu ích ở những trẻ đẻ non chọn lọc khi sự gắng sức của chính bệnh nhân làm cản trở sự thông khí và có thể giảm tỷ lệ mắc phải tràn khí màng phổi trong nhóm bệnh nhân này. Perlman và cộng sự đã chứng minh rằng loại trừ sự giao động của vận tốc lưu lượng máu qua não bằng thuốc liệt cơ đã làm giảm tỷ lệ mắc phải xuất huyết não thất ở những trẻ đẻ non bị bệnh màng trong. Người ta cũng đã đề nghị rằng thuốc liệt cơ có thể làm giảm sự tiêu thụ oxy; điều này thuận lợi cho những bệnh nhân bị tổn thương sự oxy hóa. Sử dụng thuốc liệt cơ kéo dài trên 2 tuần làm chậm phát triển cơ xương sau đó. Điều quan trọng, về mặt cơ học phổi, Bhutani và cộng sự đã cho thấy giảm sự đàn hồi phổi động và tăng sức đề kháng phổi toàn bộ chỉ sau 48 giờ liệt cơ liên tục bằng pancuronium. Cả hai chỉ số này cải thiện 41% đến 43% lúc 6 đến 18 giờ sau khi ngừng sử dụng liệt cơ. Sự gắng sức hô hấp tự phát dường như góp phần rất ít đến thông khí phút ở những trẻ đẻ non bị bệnh rất nặng có đàn hồi phổi thấp. Những bệnh nhân này có nguy cơ giảm dung tích cặn chức năng sau khi dùng thuốc giãn cơ, có thể thông qua sự mất cơ chế hãm của đường hô hấp trên. Ở những bệnh nhân có độ đàn hồi phổi ít bị tổn thương và ở những bệnh nhân lớn hơn, sự gắng sức hô hấp tự phát góp phần đáng kể cho thông khí toàn bộ. Như vậy, điều chỉnh máy thở (thường tăng tần số) cần thiết để dự phòng giảm thông khí đáng kể khi chỉ định thuốc liệt cơ. Theo dõi khí máu, áp lực dioxide carbon cuối kỳ thở ra, hoặc cả hai, được khuyến cáo. Mặc dù mất trương lực cơ gian sườn có thể dẩn đến sự gia tăng áp lực trong lòng ngực, điều này dường như không gây ra sự tăng sự đề kháng hô hấp. Nguy hiểm chính trong khi sử dụng thuốc giãn cơ là tụt ống nội khí quản kín đáo. Trẻ sơ sinh được sử dụng thuốc giãn cơ phụ thuộc hoàn toàn vào thông khí cơ học và cần phải giám sát kỹ. Cũng vậy, sự liệt cơ làm mờ đi nhiều dấu hiệu lâm sàng mà sự thể hiện phụ thuộc vào trương lực cơ và sự vận động, như là co giật. Cuối cùng, thuốc liệt cơ không thay đổi cảm giác đau, như vậy, nên chỉ định thuốc giảm đau giống như được chỉ định cho những bệnh nhân không được điều trị thuốc liệt cơ. Trong thực hành, quyết định chỉ định một thuốc giãn cơ hầu như dựa vào quan sát lâm sàng một bệnh nhân kết hợp với đo khí máu động mạch. Các thuốc giãn cơ được sử dụng thường làm thuận lợi liệu pháp tăng thông khí. Phân tích các dạng sóng máy thở và áp lực thực quản là một phương pháp khách quan hơn để đánh giá bệnh nhân trong giai đoan thở máy và áp lực trong lồng ngực trung bình có tăng hay không. Tuy nhiên, không có cách tin cậy nào tiên đoán những bệnh nhân nào trong trường hợp như vậy sẽ có lợi nhờ thuốc liệt cơ. Như vậy, các thuốc giãn cơ nên được chỉ định như là một thử nghiệm điều trị và tiếp tục sử dụng nếu các giá trị khí máu động mạch cải thiện, nếu sự chăm sóc của điều dưỡng được đơn giãn hoặc nếu sự dễ chịu của bệnh nhân rõ ràng. Nếu các biến chứng của sử dụng thuốc liệt cơ kéo dài đã được dự phòng, cần thiết phải đánh giá định kỳ bệnh nhân trong giai đoan không dùng thuốc liệt cơ. Thuốc giãn cơ khử cực tác dụng ngắn succinylcholine hiếm khi được sử dụng trong điều trị sơ sinh, ngoại trừ khi cần thiết liệt cơ để đặt nội khí quản; do đó, trong phần này chỉ bàn luận đến những thuốc không khử cực được sử dụng phổ biến. Các liều khuyến cáo được liệt kê trong bảng 2.
Pancuronium[sửa]
Pancuronium bromide, thuốc cạnh tranh thần kinh cơ, tác dụng kéo dài là thuốc giãn cơ được sử dụng phổ biến cho sơ sinh. Gallamine và D-tubocurarine hiếm được sử dụng vì tác dụng tim mạch đáng kể, phong tỏa hạch giao cảm và galamine bắt buộc đào thải qua thận. Tất cả các thuốc này ngăn cản sự dẩn truyền tại chỗ nối thần kinh cơ bằng cách cạnh tranh với acetylcholine tại các vị trí receptor tại màng sau chỗ nối. Pancuronium có các tác dụng phân ly dây thần kinh phế vị và thường thấy tăng tần số tim trong quá trình sử dụng. Pancuronium, được chỉ định đường tĩnh mạch, tạo tác dụng gây liệt tối đa trong 2 đến 4 phút. Thời gian ngưng thở sau một liều duy nhất là thay đổi và được kéo dài ở trẻ sơ sinh và có thể kéo dài từ 1 đến nhiều giờ. Các liều tăng dần làm tăng thời gian liệt cơ hô hấp. Thêm vào đó, thời gian liệt bị kéo dài do tình trạng nhiễm toan, hạ kali máu, sử dụng kháng sinh aminoglycoside và chức năng thận giảm. Tình trạng nhiễm kiềm làm trung hòa sự phong tỏa. Mặc dù thận là con đường bài tiết chính của pancuronium, một phần đáng kể của thuốc được bài tiết qua gan mật và sự chuyển hóa. Liều khuyến cáo ở trẻ sơ sinh thay đổi từ 0,06 đến 0,1 mg/kg (xem bảng 2). Mặc dù theo thói quen, chỉ định liều lặp lại bằng với liều đã cho lần đầu, những liều tiếp theo bằng nửa liều ban đầu có thể có hiệu quả gây liệt kéo dài khi hoạt động cơ hoặc hô hấp tự phát trở lại. Chuyền dịch liên tục pancuronium ở trẻ sơ sinh thường kết hợp với khả năng tích lũy vì tốc độ bài tiết chậm ở những bệnh nhân này; như vậy, phương pháp chỉ định này tốt nhất nên tránh trừ khi có sẵn sự theo dõi điện sinh lý. Các lợi ích kéo dài của liệt hô hấp cần phải cân bằng với các biến chứng tiềm tàng. Sử dụng kéo dài pancuronium đã có liên quan đến sự mất thính lực thần kinh cảm giác ở những bệnh nhân bị thoát vị cơ hoành bẩm sinh sống sót. Các tác dụng của pancuronium có thể được đảo ngược nhanh chóng khi sử dụng thuốc anticholinesterase neostigmine 0,08 mg/kg tĩnh mạch, sau khi đã chỉ định glycopyrrolate 2,5 đến 5 µg/kg, thuốc ngăn cản các tác dụng phụ muscarinic. Mặc dù hiếm khi cần tác dụng ngược lại nhanh chóng vì lý do thuốc ở trẻ sơ sinh đang được thông khí hổ trợ, đôi khi có thể hữu ích về mặt chẩn đoán ở những bệnh nhân đang được xem xét có tổn thương hệ thần kinh trung ương trong khi gây liệt.
Vecuronium[sửa]
Vecuronium là một thuốc giãn cơ không khử cực có tác dụng ngắn, thuốc có liên quan về mặt cấu trúc với pancuronium. Khởi phát tác dụng 1,5 đến 2 phút sau khi chuyền bolus tĩnh mạch, nhưng thời gian tác dụng chỉ 30 đến 40 phút. Thuốc ít có tác dụng phụ trên tim mạch và được bài tiết nhanh chónh qua mật. Như vậy, thuốc an toàn hơn pancuronium khi có suy thận. Nhiễm toan làm tăng sự phong tỏa thần kinh cơ của vecuronium và nhiễm kiềm làm trung hòa nó. Vecuronium thường được cho bằng cách chuyền tĩnh mạch liên tục với tốc độ 0,1 mg/kg/giờ sau liều bolus gây liệt ban đầu 0,1 mg/kg. Người ta thích sử dụng chuyền liên tục trong một số bệnh nhân sau phẫu thuật tim mạch khi sự cử động hô hấp hoặc các cơ khác có thể hủy hoại sự thành công của sửa chữa phẫu thuật. Các tác dụng của vecuronium có thể bị đảo ngược bằng chỉ định neostigmine, như đã được mô tả với pancuronium
| BẢNG 2. Các thuốc phong tỏa thần kinh cơ cho sơ sinh | |||
| Thuốc | Liều đầu tiên (mg/kg) | Lặp lại liều | Liều chuyền tĩnh mạch (mg/kg/giờ) |
| Pancuronium | 0,04-0,15 | 1-4 giờ | Không khuyến cáo |
| Vecuronium | 0,03-0,15 | 1-2 giờ | 0,05-0,1 |
- Các liều tăng dần, 50 đến 100% liều đầu tiên
CÁC THUỐC TRỢ TIM[sửa]
Hạ huyết áp phổ biến ở trẻ sơ sinh đẻ non bị bệnh màng trong. Ở những trẻ sơ sinh 23 đến 27 tuần tuổi thai, từ 47% đến 67% sẽ cần hổ trợ co bóp cơ tim vì hạ huyết áp. Các dấu hiệu của choáng tim và các dấu hiệu báo trước cũng có thể được nhận thấy ở những trẻ sơ sinh đủ tháng sau ngạt chu sinh, trong quá trình thiếu oxy máu nặng hoặc các rối loạn chuyển hóa, một số trường hợp bệnh tim bẩm sinh và trong quá trình nhiễm trùng huyết. Khi những cố gắng làm giảm nhu cầu oxy và hổ trợ tuần hoàn không đầy đủ, sử dụng các thuốc trợ tim có thể cứu sống bệnh nhân. Sự phát triển điều trị hợp lý và đặc thù cần phải có kiến thức về các tác dụng quan trọng của các thuốc có sẵn cho trẻ sơ sinh, cũng như các kỹ thuật đánh giá và theo dõi chức năng tim mạch của bệnh nhân. Các áp lực đổ đầy tĩnh mạch trung tâm và cung lượng tim có thể khó xác định ở trẻ sơ sinh và không được đo thường quy. Khi có thể, những biện pháp này nên kết hợp với xác định tần số tim thông thường, huyết áp hệ thống và các giá trị khí máu động mạch có thể cung cấp một cơ sở khách quan hơn để chọn lựa và thao tác các thuốc tăng co bóp cơ tim. Siêu âm tim có thể cung cấp nhiều chỉ số của chức năng tim có thể hữu ích để hướng dẩn điều trị với các thuốc vận mạch. Chẳng hạn, Lopez và cộng sự đã sử dụng siêu âm tim đã chứng minh rằng các trẻ sơ sinh đẻ non bị bệnh màng trong được điều trị kết hợp dopamine và doputamine có chức năng tim rất bình thường mặc dù có huyết áp thấp hơn so với những bệnh nhân nhóm chứng. Bác sỹ cần sử dụng siêu âm tim để quyết định khi nào một trẻ sơ sinh cần sự hổ trợ của thuốc trợ tim và đánh giá sự đáp ứng với thuốc. Tình trạng phát triển của hệ tim mạch và sự chuyển tiếp từ tình trạng thai sang sơ sinh đã làm sự quyết định về điều trị ở sơ sinh phức tạp hơn, đặc biệt là những bệnh nhân sinh non tháng. Cơ tim chưa trưởng thành có nhiều yếu tố không co bóp hơn so với người trưởng thành và sự định hướng của các yếu tố co bóp dường như chưa được tổ chức tốt. Cũng vậy, các receptor tim mạch đối với các amine kích thích giao cảm có thể khác về số lượng, sự phân bố và sự nhạy cảm hơn so với của người trưởng thành. Bình thường, tim của trẻ sơ sinh dường như không có chức năng ở các mức độ co bóp gần cực đại; như vậy, các phản ứng đảo ngược và co bóp cơ tim có thể bị hạn chế. Hậu tải dường như là một yếu tố quyết định quan trọng của cung lượng tim trong tình trạng sơ sinh. Thêm vào đó, tuần hoàn phổi phản ứng của sơ sinh và khả năng có shunt qua các con đường thai có thể làm tổn thương sự cung cấp oxy và tăng nhu cầu của cơ tim. Những nổ lực tăng cung lượng tim bằng thuốc nên được xử lý trước đó bằng các chiến lược điều chỉnh tình trạng giảm oxy máu, nhiễm toan máu, hạ đường máu, hạ calci máu, giảm thể tích máu và giảm các nhu cầu chuyển hóa. Cung lượng tim là tích của thể tích một lần bóp của thất trái và tần số tim (cung lượng tim = thể tích nhát bóp x tần số tim). Tần số tim có thể tăng tạm thời bằng phân ly thần kinh phế vị bởi atropin hoặc, phổ biến hơn, bằng các thuốc điều nhịp như là isoproterenol hoặc epinephrine đường chuyền liên tục. Tăng tần số tim 30% thường có thể đạt được sự tăng tương tự cung lượng tim. Thể tích mỗi nhát bóp có thể được tăng bằng cách tăng tiền tải (hồi lưu tĩnh mạch), giảm hậu tải (đề kháng mao mạch hệ thống), hoặc tăng sự co bóp cơ tim. Các thuốc có khả năng tăng sự co bóp (hiệu quả co bóp dương tính) bao gồm một số amine kích thích giao cảm, các glycoside tim, glucagon và các xanthine. Chỉ có các amine kích thích giao cảm hiện tại có tầm quan trọng lâm sàng thực hành trong điều trị choáng. Các amine kích thích giao cảm là những thuốc co bóp cơ tim dương tính mạnh nhất hiện có. Những thuốc này có các tác dụng phức tạp tùy thuộc vào sự tương tác của chúng với các receptor đặc hiệu và sự phân bố của các receptor này ở vật chủ. Các nghiên cứu rộng rãi đã đưa đến sự phân loại các receptor như là alpha-adrenergic, beta-adrenergic hoặc dopaminergic. Những receptor này nằm ở tim và các mạch máu cũng như ở gan, thận, tụy và tận cùng thần kinh. Các receptor dopaminergic làm trung gian giãn các tiểu động mạch thận, mạc treo, vành và não đã được mô tả. Các tác dụng của receptor liên quan đến các vị trí ở hệ tim mạch được liệt kê trong bảng 3. Chuyển hóa của tất cả các catecholamine giống nhau. Catechol-O-methyltransferase (CMOT) chịu trách nhiệm thoái giáng của hầu hết các thuốc chỉ định ngoại sinh và monoamine oxidase tham gia một phần nhỏ. Hoạt tính của COMT có sự thay đổi lớn giữa các bệnh nhân và tăng từ hai đến sáu lần trong quá trình điều trị dopamine. Tất cả các catecholamine đều có nữa đời ngắn xấp xỉ 2 phút; do đó, cần chuyền tĩnh mạch liên tục để đạt được hiệu quả kéo dài. Tuy nhiên, ở các trẻ sơ sinh non tháng bị bệnh, nữa đời và độ thanh thải clearance có thể kéo dài và có thể tăng đáp ứng khi chuyền dịch. Các chất chuyển hóa và có thể 20% các chất không thay đổi được bài tiết qua nước tiểu.
| BẢNG 3. Các tác dụng tim mạch của các receptor adrenergic | ||
| Receptor Adrenergic | Vị trí | Tác dụng |
| Beta1 | Cơ tim | Tăng co bóp tâm nhĩ và tâm thất |
| Nút nhĩ thất | Tăng tần số tim | |
| Hệ dẩn truyền nhĩ thất | Tăng dẩn truyền | |
| Beta2 | Các tiểu động mạch | Giãn mạch |
| Alpha1 | Các tiểu động mạch ngoại vi | Co mạch |
| Dopamine | Các tiểu động mạch thận, não, mạc treo và vành | Giãn mạch |
Các thuốc điều trị hiện nay có phạm vi hoạt động từ tác dụng alpha đơn thuần đến tác dụng beta đơn thuần. Các tác dụng dược lý của các catecholamine epinephrine, norepinephrine, dopamine, dobutamine và isoproterenol liên quan đến tính chọn lọc của thuốc và hiệu lực kích thích các receptor adrenergic, như được tóm tắt trong bảng 4.
| BẢNG 4. Tính chọn lọc của các Catecholamine đối với các receptor Adrenergic | ||||
| Receptor | ||||
| Catecholamine | Alpha1 | Beta1 | Beta2 | Dopamine |
| Epinephrine | +++ | +++ | +++ | - |
| Norepinephrine | +++ | +++ | + | - |
| Isoproterenol | - | +++ | +++ | - |
| Dopamine* | - đến +++ | - đến +++ | ++ | +++ |
| Dobutamine | - đến + | +++ | + | - |
+ Mức độ kích thích tương đối; - không kích thích
- Thay đổi, các tác dụng phụ thuộc vào liều. Liều cao tạo các tác dụng alpha1-adrenergic ưu thế.
Vì norepinephrine có lợi ích lâm sàng hạn chế trong sơ sinh, ở đây chỉ bàn luận đến dopamine, dobutamine, isoproterenol và epinephrine. Các liều khuyến cáo của các thuốc này được liệt kê trong bảng 5.
| BẢNG 5. Các thuốc co bóp cơ tim điều trị choáng cho trẻ sơ sinh | |||
| Thuốc | Liều (µg/kg/phút) | Receptor ảnh hưởng | Tác dụng |
| Dopamine | 2-4 | Dopaminergic | Tăng lưu lượng máu đến thận và mạc treo |
| 4-10 | Beta1 | Tăng có bóp cơ tim | |
| >10 | Alpha1 + beta1 | Co mạch ngoại biên kèm tác dụng tim | |
| Dobutamine | <10 | Beta1 | Tăng co bóp cơ tim |
| >10 | Alpha1 + beta1 | Giãn mạch ngoại biên kèm tác dụng tim | |
| Isoproterenol | 0,05-0,50 | Beta1 + beta2 | Tần số tim nhanh thường kèm với các tác dụng co bóp và mạch máu |
Dopamine[sửa]
Dopamine là một catecholamine tìm thấy trong tự nhiên. Chỉ định ngoại sinh, thuốc có các tác dụng tim mạch phức tạp liên quan đến liều (xem bảng 5). Với liều thấp (<4 µg/kg/phút), thuốc có các tác dụng giãn mạch ban đầu trên các tiểu động mạch thận, mạc treo, vành và não. Tuy nhiên, ở trẻ sơ sinh đẻ non, thuốc có thể gây tăng huyết áp ngay cả với liều thấp này, có thể do độ thanh thải clearance giảm. Liều lớn hơn (5 đến 10 µg/kg/phút) có tác dụng có bóp cơ dương tính trên cơ tim thông qua sự giải phóng norepinephrine từ các tận cùng thần kinh và thông qua tác dụng trực tiếp trên các receptor beta1-adrenergic trong cơ tim. Các liều lớn hơn 10µg/kg/phút gây tăng sự đề kháng mạch máu hệ thống thông qua sự kích thích của các receptor alpha-adrenergic. Các liều lớn hơn 20 µg/kg/phút có thể gây tăng sự đề kháng mạch máu phổi. Dopamine có hiệu quả trong điều trị hạ huyết áp ở các trẻ đẻ non bị bệnh màng trong. Trong nhóm bệnh này, liều thấp 2 µg/kg/phút có khuynh hướng tăng huyết áp, mặc dù các nghiên cứu cho thấy liều trung bình có hiệu quả là 7,5 đến 12,5 µ/kg/phút để điều trị hạ huyết áp. Dopamine thường được sử dụng trong điều trị trẻ sơ sinh bị rối loạn chức năng cơ tim. Thuốc được sử dụng phổ biến cho trẻ sơ sinh bị suy thận để cải thiện lượng nước tiểu. Thuốc cũng được sử dụng để dự phòng các tác dụng hạ huyết áp của các thuốc giãn mạch phổi trong điều trị tăng áp phổi ở trẻ sơ sinh. Các biến chứng như là loạn nhịp và bong da hoại thư (do dịch chuyền dopamine rỉ ra) thường được thấy. Tóm lại, tốc độ của chuyền dịch dopamine phải xác định tùy thuộc từng bệnh nhân, tùy thuộc vào những thay đổi cung lượng tim, lượng nước tiểu, huyết áp và tưới máu ngoại vi mong muốn. Ờ các trẻ đẻ non, ngay cả liều thấp của dopamine có thể ảnh hưởng đến huyết áp thông qua tăng hậu tải.
Dobutamine[sửa]
Dobutamine là một dẩn xuất của isoproterenol và có cấu trúc tương tự như cấu trúc của dopamine. Tuy nhiên, thuốc không có các đặc tính dopaminergic và dường như kích thích tim chính thông qua các receptor beta1. Với liều lớn hơn (>10 µg/kg/phút), sự kích thích của các receptor mạch máu xảy ra, sự kích thích beta2 ưu thế hơn so với kích thích alpha1. Sự giãn mạch ngoại vi xảy ra, ngược lại sự co mạch do sử dụng liều tương tự như dopamine. Tác dụng co bóp cơ tim của dobutamine dường như tương tư như tác dụng của dopamine ở trẻ sơ sinh. Tuy nhiên, ở trẻ sơ sinh đẻ non, dobutamine dường như có hiệu quả hơn tăng cung lượng thất trái, trong khi dopamine dường như có hiệu quả hơn tăng huyết áp trung bình. Liệu pháp kết hợp dobutamine với liều thấp của dopamine có nhiều triển vọng hơn so với điều trị mỗi loại thuốc đơn độc. Loạn nhịp là tác dụng phụ ít gặp, nhưng tăng shunt của máu trong phổi có thể xảy ra với dobutamine cũng như với dopamine và isoproterenol.
Isoproterenol[sửa]
Isoproterenol là một catecholamine tổng hợp hầu như chỉ có các tác dụng beta-adrenergic. Vì các receptor beta1- và beta2-adrenergic bị kích thích, hoạt động cơ tim tăng và giãn mạch ngoại vi xảy ra. Tần số tim tăng và huyết áp thấp có thể xảy ra khi sử dụng ở sơ sinh. Khi tần số tim tăng, sự tiêu thụ oxy của cơ tim tăng, đồng thời, sự cung cấp oxy cho cơ tim giảm do có hạ huyết áp. Đối với sơ sinh, isoproterenol dường như là một thuốc thứ yếu để điều trị choáng. Thuốc có thể được áp dụng trong trường hợp cần giảm hậu tải và khi có thể chịa đựng được sự tăng tần số tim. Thuốc có thể có lợi ích ngắn ở những bệnh nhân bị block tim hoàn toàn và đã được sử dụng để làm giảm áp lực động mạch phổi ở bệnh nhân bị bất thường Ebstein. Liều thay đổi từ 0,05 đến 0,5 µg/kg/phút.
Epinephrine[sửa]
Epinephrine là một catecholamine nội sinh có cả hai tác dụng alpha- và beta-adrenergic. Các tác dụng tương đối phụ thuộc vào liều. Ở liều thấp, tác dụng beta-adrenergic chiếm ưu thế, kết quả sự co bóp và cung lượng tim tăng. Ở liều cao hơn, các tác dụng alpha-adrenergic phát triển và kết quả co mạch ngoại vi có thể bù lại các tác dụng beta-adrenergic mong muốn. Liều thay đổi từ 0,05 đến 0,50 µg/kg/phút. Tóm tắt Rối loạn chức năng cơ tim do giảm cung lượng tim có thể kèm với sự kết hợp tăng hoặc giảm sự đề kháng ngoại vi, giảm thể tích máu, hoặc tăng thể tích máu và do tăng hoặc giảm các tốc độ chuyển hóa. Như vậy, sự đánh giá lâm sàng hợp lý và đo huyết động là cần thiết để chọn lựa và tính liều của các thuốc trợ tim. Tóm tắt các thuốc tăng co bóp cơ tim được sử dụng trong điều trị choáng được cho trong bảng 5.
CÁC THUỐC GIÃN MẠCH PHỔI[sửa]
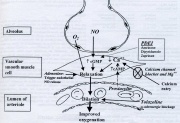
Tăng áp phổi tồn tại ở sơ sinh (PPHN) có shunt máu phải qua trái qua ống động mạch, lỗ bầu dục, hoặc cả hai có thể gây giảm oxy máu nặng ở trẻ sơ sinh có bị hoặc không bị bệnh phổi. Mặc dù PPHN có nhiều nguyên nhân và một số những nguyên nhân này là thoát vị hoành bẩm sinh, sự đóng sớm của ống động mạch và sự giảm oxy máu trong tử cung mạn tính, biểu hiện sự thay đổi cấu trúc trong cơ trơn mạch máu phổi. Các thuốc làm giảm sự đề kháng mạch máu phổi có thể là điều trị có ích PPHN khi tình trạng giảm oxy máu khó chữa với thông khí cơ học và liệu pháp O2. Các chất làm giảm sự đề kháng mạch máu phổi được miêu tả bằng biểu đồ trên hình 1. Kinh nghiệm lâm sàng với adenosine, magnesium sulfate, các thuốc chẹn kênh calcium, prostaglandin E1, prostaglandin D2 và prostacyclin còn hạn chế. Mặc dù tolazoline vẫn còn được sử dụng hiếm hoi, thuốc có tác dụng giãn mạch không mong muốn trên hệ mạch máu hệ thống. Sử dụng oxy nồng độ cao và các thuốc kiềm hóa để tăng pH máu, đôi khi kết hợp với tăng thông khí, hiện nay vẫn còn là chiến lược giãn mạch chủ yếu ở trẻ sơ sinh bị PPHN. Nitric oxide hít đã được FDA chấp nhận sử dụng cho trẻ sơ sinh.
Các chất gây kiềm[sửa]
Các chất kiềm máu để tạo ra pH máu từ 7,5 đến 7,6 dường như là liệu pháp giãn mạch phổ biến nhất, cùng với liệu pháp O2, hiện nay được sử dụng để điều trị PPHN. Cơ chế không được thiết lập rõ ràng nhưng dường như phụ thuộc trực tiếp vàp pH của máu và không phụ thuộc vào sự giải phóng nitric oxide. Không có áp lực riêng phần của CO2 tồn tại (Paco2). Như vậy, nhiềm kiềm hô hấp, nhiễm kiềm chuyển hóa, hoặc sự kết hợp cả hai có thể được sử dụng để tạo sự tăng mong muốn pH. Bicarbonate natri, acetate natri và tromethamine (THAM) tất cả được sử dụng để tạo kiềm, có các kết quả tương tự; do đó, sự chọn lựa một trong những thuốc gây kiềm này thường hay phụ thuộc vào các trường hợp lâm sàng. Acetate natri cần phải trao đổi bicarbonate trong gan và không nên sử dụng khi có giảm oxy máu kéo dài, giảm tưới máu hoặc rối loạn chức năng gan. Khi tăng Paco2 đáng kể hoặc quá tải natri, một số bác sỹ thích dùng THAM hơn. THAM kết hợp với các ion hydrogen, gây ra sự tăng các ion bicarbonate. Mặc dù THAM có thể thay đổi pH nội bào nhanh hơn bicarbonate natri, đặc tính này dường như không là một yếu tố có ý nghĩa trong hiệu quả giãn mạch phổi. THAM có thể gây tăng kali máu và hạ đường máu; do đó sự chỉ định của nó không được chỉ định cho các bệnh nhân bị vô niệu hoặc hạ đường máu. Điều trị bắt đầu bằng chuyền bolus 1 đến 2 mEq/kg bicarbonate natri hoặc 1 đến 2 mmol/kg THAM. Sau đó bắt đầu chuyền dịch liên tục để đạt được pH mong muốn. Mặc dù mỗi bệnh nhân có thể có pH riêng biệt mà bệnh nhân phản ứng, pH thông thường giữa 7,50 và 7,60. Sau khi đã đạt được pH mong muốn, có thể giảm tốc độ chuyền kiềm. Sự chuyền có thể được ngừng sau khoảng 48 giờ và bệnh nhân vẫn còn nhiễm kiềm trong nhiều ngày khi bicarbonate hoặc THAM được đào thải chậm qua thận.
Hình 1. Các chất khác nhau làm giảm sự đề kháng mạch máu phổi được minh họa bằng biểu đồ. Nitric oxide và các chất ức chế phosphodiesterase (PDEI) làm trung gian giãn mạch bằng cách tăng số lượng guanosine monophosphate vòng (cGMP). Các chất chẹn kênh calcium và magnesium (bằng cách ức chế cạnh tranh) cản trở đường vào của calcium vào cơ trơn mạch máu, làm giảm sự dự trữ calcium nội bào và dẩn đến giãn mạch. Prostacyclin tạo ra sự giảm số lượng của adenosine monophosphate vòng (cAMP), cũng giảm calcium nội bào. Các cơ chế tác dụng của adenosine, tolazoline và oxy (O2) đưa đến giãn mạch cũng được mô tả. Các tác dụng phụ của nhiễm kiềm, bao gồm tăng ái lực của hemoglobin với O2, giảm nồng độ calcium ion hóa và giảm lưu lượng máu qua não đã không được báo cáo là những vấn đề trong khi điều trị bệnh nhân bị PPHN. Tỷ lệ mắc phải thấp của điếc thần kinh cảm giác đã được quan sát ở những bệnh nhân bị PPHN sống sót. Chuyền nhanh bicarbonate natri ưu trương có thể đóng vai trò trong xuất huyết nội sọ ở trẻ sơ sinh đẻ non và khuyến cáo rằng nồng độ bicarbonate natri không vượt quá 0,5 mEq/mL và không được chuyền với tốc độ lớn hơn 1 mEq/mL/phút. Chuyền bicarbonate sẽ tăng thoáng qua Paco2 nhưng dường như không quan trọng về mặt lâm sàng ở những bệnh nhân được thông khí cơ học hiệu quả. Các thuốc gây kiềm hóa, đặc biệt THAM, chỉ nên cho bằng đường tĩnh mạch, vì chỉ định đường động mạch của những dung dịch này đã kết hợp những biến chứng mạch máu đáng kể.
Tolazoline[sửa]
Tolazoline hydrochloride đã được sử dụng rộng rãi như là thuốc giãn mạch máu phổi. Tolazoline, được phân loại như thuốc chẹn alpha-adrenergic, cũng được biết các tác dụng kích thích giao cảm, kích thích phó giao cảm và giống histamine. Nhiều tác dụng giãn mạch máu phổi của tolazoline là do tương tác với các receptor H1 và H2 trong tuần hoàn phổi và không làm trung gian qua sự sản xuất nitric oxide. Tolazoline được bài tiết không thay đổi trong nước tiểu bằng các phương tiện kết hợp lọc cầu thận và bài tiết ống thận bằng hệ thống vận chuyển tích cực cho các base hữu cơ. Ở trẻ sơ sinh, nửa đời thay đổi từ 3,3 đến 33 giờ và phụ thuộc lớn vào lượng nước tiểu. Tolazoline thường được chỉ định tiêm tĩnh mạch trong các mạch máu đưa máu về tĩnh mạch chủ trên. Liều ban đầu 1 đến 2 mg/kg được tiêm trong nhiều phút, sau đó chuyền 1 đến 2 mg/kg/giờ. Tùy thuộc vào sự đáp ứng, thuốc có thể được tăng 4 đến 6 mg/kg/giờ, nhưng cần phải thận trọng vì nữa đời có khả năng dài của tolazoline. Hiện nay không rõ rằng chuyền tĩnh mạch liên tục của thuốc này có an toàn hay không, đặc biệt khi có thiểu niệu. Đáp ứng dương tính với tolazoline, được chứng tỏ bởi sự tăng Pao2 15 mm Hg hoặc hơn trong 15 đến 60 phút đã chỉ định thuốc, xảy ra 30% đến 60% số bệnh nhân bị PPHN. Khi phân suất khí O2 thở vào đã được làm giảm đến 0,6, tốc độ chuyền của tolazoline có thể được làm giảm mỗi 6 đến 12 giờ nếu Pao2 không diễn tiến xấu đi. Khi có rối loạn chức năng cơ tim hoặc hạ huyết áp toàn thân, cần sử dụng thuốc trợ tim trước khi chuyền tolazoline. Chuyền dịch dopamine được liên tục trong khi chuyền tolazoline dường tỏ ra có ích trong trường hợp này, Cần chú ý rằng tolazoline cũng có các tác dụng kích thích tim, có thể có ích lợi khi có rối loạn chức năng cơ tim. Các tác dụng phụ liên quan đến chuyền tolazoline đã được thấy từ 30% đến 80% bệnh nhân. Khi có giãn mạch da (da ửng đỏ) cho bằng chứng liều điều trị đã đạt. Hạ huyết áp toàn thân đáp ứng tốt với chuyền máu, dung dịch keo hoặc muối. Tăng huyết áp hiếm và được giải quyết khi tốc độ chuyền tolazoline được giảm. Thường thấy chướng bụng và cần sử dụng đúng hút qua mũi dạ dày. Nếu có xuất huyết dạ dày, sử dụng thuốc kháng acid có thể có ích. Thiểu niệu thường xày ra; như vậy, khuyến cáo cần chỉ định dịch cẩn thận. Với liều cao hơn (4 đến 6 mg/kg/giờ), người ta đã ghi nhận có sự kích thích hệ thần kinh trung ương. Vì nhiều tác dụng của thuốc, tolazoline cần phải được sử dụng thận trọng sau khi đã cân nhắc cẩn thận giữa các nguy cơ và các lợi ích của điều trị. Do tác dụng toàn thân của tolazoline và sự ra đời của nitric oxide, sử dụng tolazoline đã giảm đáng kể. Chỉ định tolazoline nội khí quản là phương pháp để ngăn chặn các vấn đề khi chỉ định đường toàn thân trong khi cũng đạt các kết quả giãn mạch phổi dương tính. Parida và cộng sự chỉ định nội khí quản tolazoline cho 12 trẻ sơ sinh có tuổi thai từ 25 đến 42 tuần và bị tăng áp phổi tồn tại (PPHN). Các bệnh nhân đã biểu hiện sự tăng đáng kể độ bão hòa oxy động mạch, giảm chỉ số oxy và không có hạ huyết áp toàn thân.
Các thuốc khác[sửa]
Các thuốc khác đã thể hiện giá trị trong điều trị PPHN trong các thử nghiệm lâm sàng nhỏ. Sự thật là các thử nghiệm ngẫu nhiên lớn của nitric oxide đã không cho thấy sự cải thiện rõ rệt về tỷ lệ tử vong hoặc giảm thời gian nằm viện, nhiều thuốc này có thể được thử nghiệm kết hợp với nitric oxide trong tương lai.
Adenosine[sửa]
Adenosine là một purine nucleoside có nửa đời ngắn (< 10 giây) và gây giãn mạch do kích thích các receptor A2 nhạy cảm theophylline trong các tế bào nội mô mạch máu và tiếp đến giải phóng nitric oxide từ các tế bào nội mô. Adenosine nội sinh đã được chứng minh đóng vai trò quan trọng trong việc thúc đẩy sự giảm sự đề kháng mạch máu phổi sau khi sinh. Hai nghiên cứu nhỏ đã đánh giá các tác dụng của chuyền dịch adenosine cho trẻ sơ sinh bị PPHN. Trong một nghiên cứu mù ngẫu nhiên có đối chứng với placebo, Konduri và Woodard đã chuyền adenosine với liều 25 đến 50 µg/kg/phút trong thời gian 24 giờ và so sánh các tác dụng trên Pao2 với các trẻ sơ sinh được chuyền bằng dung dịch muối. Các kết quả đã cho thấy sự cải thiện Pao2 từ 69 ± 19 lên 94 ± 15. Huyết áp động mạch và tần số tim không thay đổi trong quá trình chuyền adenosine. Patole và cộng sự đã sử dụng adenosine để điều trị sáu trẻ sơ sinh bị PPHN không có đáp ứng với điều trị thông thường. Tăng Pao2 lớn hơn 20 mm Hg xảy ra 5 trong 6 trường hợp sau 30 bắt đầu chuyền dịch. Không có các tàc dụng phụ (chậm nhịp tim, hạ huyết áp, thời gian chảy máu kéo dài) nào được ghi nhận.
Magnesium Sulfate[sửa]
Magnesium Sulfate là một thuốc điều trị gây giãn mạch bằng cách cản trở calci đi vào các tế bào cơ trơn. Thuốc cũng có tác dụng do tác động vào cơ chế của prostagladin, ức chế sự giải phóng của các catecholamines, hoạt hóa adenyl cyclase và giảm tác dụng của cơ trơn với các thuốc co mạch. Magnesium cũng có các tác dụng khác bao gồm chống huyết khối, an thần, giãn cơ và giảm tổn thương mô qua trung gian các chất oxy hóa sau sự thiếu máu cục bộ-giảm oxy máu. Nhiều nghiên cứu đã báo cáo các tác dụng có lợi của điều trị magnesium sulfate cho các bệnh nhân bị PPHN. Những nghiên cứu này nhỏ, không ngẫu nhiên. Tolsa và cộng sự đã chỉ định liều tải 200 mg/kg magnesium sulfate trong 20 phút, sau đó chuyền dịch 20 đến 150 mg/kg/giờ để duy trì nồng độ huyết thanh từ 3,5 đến 5,5 mmol/L ở các trẻ sơ sinh bị PPHN. Chỉ số oxy và áp lực đường thở trung bình giảm đáng kể sau 72 giờ điều trị, không có hạ huyết áp toàn thân hoặc các tác dụng phụ khác được ghi nhận.
Các thuốc chẹn kênh Calci[sửa]
Thiếu tính đặc hiệu trên phổi, tỷ lệ các tác dụng phụ cao và thiếu đáp ứng có thể dự đoán được ở người lớn đã cho thấy cần phải thận trọng khi sử dụng các thuốc chẹn kênh calci cho các trẻ sơ sinh bị PPHN và các bệnh liên quan. Cho dù những lo âu này, các thuốc chẹn kênh calci có thể có một vai trò trong một số bệnh nhân bị PPHN. Islam và cộng sự sử dụng diltiazem hydrochloride cho năm trẻ sơ sinh bị tăng áp phổi tái phát kết hợp với giảm sản phổi không cải thiện với điều trị thông thường tối đa. Những trẻ sơ sinh này biểu hiện sự giảm đáng kể áp lực thất phải không có các tác dụng phụ rõ hoặc hạ huyết áp toàn thân.
Prostacyclin (Prostagladin I2)[sửa]
Prostacyclin là một chất trung gian giãn mạch phổi quan trọng. Tăng sản xuất protacyclin sau khi sinh xảy ra do sự giãn nhịp nhàng của các phế nang. Tăng sản xuất prostacyclin gây giãn mạch phổi là một yếu tố quan trọng trong sự chuyển tiếp bình thường sang đời sống ngoài tử cung. Những bệnh nhân bị tăng áp phổi nặng cho thấy cho sự thiếu prostacyclin synthase trong các mạch máu tiền mao mạch phổi. Một thử nghiệm sử dụng liều lặp lại hoặc chuyền liên tục prostacyclin qua ống nội khí quản cho bốn trẻ đẻ non bị PPHN cho thấy có sự cải thiện sự oxy hóa. Không có các tác dụng phụ nào rõ được ghi nhận. Các nghiên cứu khác đã cho thấy sự cộng lực với các thuốc khác, kể cả các chất ức chế phosphodiesterase. Như vậy, prostacyclin là một phương thức triển vọng để điều trị PPHN ở trẻ sơ sinh.
Nitric Oxide[sửa]
Điều trị Nitric Oxide đã cho bác sỹ một thuốc giãn mạch phổi chọn lọc mạnh.
CÁC CHẤT GIÃN PHẾ QUẢN VÀ CÁC THUỐC LONG ĐÀM[sửa]
Trong nhiều năm, người ta đã nghĩ rằng các trẻ đẻ non có quá ít cơ trơn tiểu phế quản để gây co thắt phế quản. Quan niệm sai lầm này đã được chứng minh là sai. Các thuốc giãn phế quản đã được chứng minh làm giảm sức đề kháng đường thở và tăng sự đàn hồi phổi ở các trẻ sơ sinh đẻ non đến 28 tuần tuổi thai bị loạn sản phổi, cũng như những trẻ khác chỉ 2 ngày tuổi bị bệnh màng trong. Các thuốc giãn phế quản sử dụng được chỉ định đường tiêm, đường ruột hoặc dưới dạng khí dung. Cùng với tác dụng giãn phế quãn, một số thuốc như aminophylline đã được chứng minh cải thiện chức năng co bóp của cơ hoành và cơ hít vào, có thể đem lại kết quả cả cải thiện thông khí và khả năng rút ống nội khí quản thành công hơn. Theophyline và caffeine, các chất methylxanthine có tác dụng giãn phế quản cũng được sử dụng như các chất kích thích hô hấp. Các liều điển hình của các thuốc khí dung thường được sử dụng được liệt kê trong bảng 6.
Albuterol (Salbutamol)[sửa]
Albuterol (cũng được biết như salbutamol) là một chất đối kháng beta2-adrenergic chọn lọc. Thuốc thúc đẩy sự sản xuất adenosine monophosphate vòng (cAMP), làm tăng sự kết hợp của calcium nội bào vào màng tế bào. Tác dụng này làm giảm nồng độ calci trong các tế bào và kết quả gây giãn cơ trơn và giãn phế quản. Denjean và cộng sự đã nghiên cứu các tác dụng của albuterol trên cơ học phổi của các trẻ đẻ non có tuổi sau khi sinh trung bình 13,3 ± 4,9 ngày và bị loạn sản phổi bán cấp. Albuterol 100 mg, được chỉ định qua khí dung định liều có buồng hít, kết quả cải thiện đáng kể cả sự đề kháng và sự đàn hồi phổi xấp xỉ 65% trong các trẻ được nghiên cứu; những trẻ còn lại cần 200 mg. Đáp ứng đỉnh xảy ra sau 30 phút và được duy trì xấp xỉ 3 giờ. Một số tác dụng toàn thân xuất hiện do tăng tần số tim. Một nghiên cứu khác nghiên cứu các trẻ sơ sinh phụ thuộc vào máy thở có trọng lượng lúc sinh nhỏ hơn 1500 g và tuổi từ 1 đến 4 tuần, albuterol cải thiện sự đàn hồi phổi; tuy nhiên, sự đề kháng đường thở không thay đổi đáng kể.
Acetylcysteine[sửa]
Các thuốc long đàm thường không cần để bảo vệ đường thở trong thông khí nhân tạo ở các trẻ sơ sinh. Tuy nhiên, acetylcysteine, một thuốc long đàm mạnh, đã có lợi ở một số trung tâm. N-Acetylcysteine, là một nhóm sulfhydryl tự do, làm lỏng chất đàm bằng cách mở các cầu nối disulfide trong mucoprotein. Thuốc không ảnh hưởng đến fibrin, các cục máu đông hoặc các mô sống. Ở một trung tâm, người ta đã sử dụng 0,1 hoặc 0,2 mL acetylcysteine cho vào ống nội khí quản hàng giờ để duy trì sự thông thương đường thở; sau đó hút các chất tiết sau 30 phút. Không thấy biến đổi về mô học trên khí quản hoặc phế quản khi xét nghiệm ở bệnh nhân tử vong. Bibi và cộng sự đã chứng minh trong 10 trẻ phụ thuộc vào máy thở (tuổi thai 27 tuần; tuổi sau sinh 22 ngày) điều trị bằng N-acetylcysteine tăng sức đề kháng đường thở đáng kể. Như vậy, sử dụng thuốc long đàm cần phải thận trọng vì các tác dụng phụ có thể lớn hơn các lợi ích của thuốc. Khi chỉ định vì mục đích long đàm, thuốc thường được kết hợp với các thuốc giãn phế quản khác như vậy các tác dụng phụ không mong muốn này được giảm đi.
Acid Cromoglycic[sửa]
Acid cromoglycic (cromolyn natri) ngăn ngừa sự giải phóng các chất trung gian gây viêm từ các dưỡng bào, ức chế sự giải phóng các bạch cầu trung tính và ức chế sự kết hợp của nicotin-amide dinucleotide phosphate oxidase hoạt động (NADPH) trong bạch cầu trung tính, do đó ngăn ngừa sự tổn thương mô do các gốc oxy gây ra. Trong một nghiên cứu các trẻ sơ sinh đẻ non lúc 29 tuần tuổi thai, bị các triệu chứng hô hấp tái pháp, bao gồm ho và thở khò khè, sự dụng acid cromoglycic khí dung dự phòng có kết quả cải thiện dung tính cặn chức năng. Mặc dù các kết quả từ nhóm nghiên cứu Cromolyn sơ sinh không chứng minh sự giảm bệnh loạn sản phổi mạn tính ở các trẻ sơ sinh được điều trị bằng cromolyn natri, sự giảm các chất chỉ điểm viêm kết hợp với bệnh loạn sản phổi mạn tính có thể được biểu hiện khi cromolyn natri được sử dụng kết hợp với surfactant, thuốc lợi tiểu và steroid.
Racemic Epinephrine (triệt quang)[sửa]
Dưới thanh môn là phần nhỏ nhất của đường thở của trẻ sơ sinh. Sự xuất hiện dị vật đường thở, xảy ra khi đặt nội khí quản kéo dài, gây phù vị trí dưới thanh môn có thể gây hẹp hơn đường thở khi trẻ sơ sinh được rút ống nội khí quản. Racemic epinephrine kích thích cả hai receptor alpha- và beta-adrenergic. Thuốc tác dụng trên cơ trơn mạch máu để gây co mạch, giảm đáng kể lưu lượng máu ở mức mao mạch. Tác dụng này làm co niêm mạc hô hấp trên và giảm phù. Racemic epinephrine là một thuốc có ích cho các bệnh nhân có thở rít sau khi rút ống nội khí quản. Hiệu quả của racemic epinephrine để ngừa thở rít sau khi rút ống nội khí quản chưa được chứng minh. Khi sử dụng racemic epinephrine, chúng ta nên biết các tác dụng phụ, bao gồm tần số tim nhanh, rối loạn nhịp, tăng huyết áp, co mạch ngoại vi, tăng đường máu, tăng kali máu, nhiễm toan chuyển hóa và tăng bạch cầu máu.
| BẢNG 6. Các thuốc khí dung cho trẻ sơ sinh | |||
| Thuốc | Liều | Thời gian dùng | Chú thích |
| Salbutamol | 0,20 mg/kg | Mỗi 3-6 giờ | Với dung dịch 0,5%, hòa loãng 0,04 mL/Kg trong 1,5 mL dung dịch muối sinh lý 18 µg/lần xịt, 1-2 lần xịt/liều với bình hít định liều |
| Ipratropium bromide | 0,025 mg/kg | Mỗi 8 giờ | |
| N-Acetylcysteine | 10-20 mg | Mỗi 6-8 giờ | Thêm thuốc giãn phế quản nếu co thắt phế quản xảy ra, sử dụng hạn chế vì các tác dụng phụ |
| Acid Cromoglycic (cromolyn natri) | 10 mg | Mỗi 6 giờ | Hòa loãng 1 mL của 10 mg/ml dung dịch với 1,5 ml muối sinh lý |
THUỐC LỢI TIỂU[sửa]
Các thuốc lợi tiểu được sử dụng để điều trị sự ứ dịch toàn thân và để làm giảm phù trong mô kẽ phổi, phù mô kẽ phổi có thể gây bất thường sự oxy hóa và thông khí và có liên quan đến sinh bệnh học của bệnh loạn sản phổi. Thuốc lợi tiểu có thể giúp làm sạch dịch kẽ phổi bằng cách di chuyển dịch này sang khoang plasma sau khi lợi tiểu nước trong khoang nội bào.
Furosemide[sửa]
Furosemide là một thuốc lợi tiểu được sử dụng phổ biến nhất cho trẻ sơ sinh bị bệnh. Liều thông thường là 1 đến 2 mg/kg tĩnh mạch. Cách thức tác dụng là ức chế sự tái hấp thu của Chlor ở nhánh lên của quai Henle. Các tác dụng phụ chính là rối loạn điện giải, bao gồm hạ natri máu, hạ kali máu, hạ chlor máu và nhiểm kiềm cũng như mất nước và giảm thể tích máu. Thêm vào đó, tăng calci máu có thể dẩn đến nhiểm calci thận. Furosemide có khả năng gây độc cho tai, nên sử dụng thận trọng cho các bệnh nhân có điều trị aminoglycoside. Điều trị furosemide đã có kết quả cải thiện ngắn hạn sự đề kháng đường thở và sự đàn hồi phổi động ở những trẻ bị bệnh màng trong. Furosemide cũng đã được chứng minh cải thiện sự đàn hồi phổi ở những bệnh nhân bị bệnh màng trong hồi phục. Tác dụng sau dường như có kết quả do các tác dụng phổi trực tiếp và không phụ thuộc vào các tác dụng lợi tiểu của thuốc. Ở những bệnh nhân bị loạn sản phổi, điều trị kéo dài có kết quả cải thiện các đặc tính cơ học của phổi không có sự thay đổi đáng kể sự trao đổi khí. Khi hít, furosemide có thể có tác dụng trực tiếp trên phổi, khi đó các tác dụng phổi có thể xảy ra nhưng không có tác dụng lợi tiểu. Ở các trẻ sơ sinh bị bệnh màng trong, sự đàn hồi và sự đề kháng cải thiện. Cách cho thuốc này có lợi làm giảm các tác dụng phụ toàn thân trong khi vẫn duy trì các tác dụng phổi mong muốn. Tuy nhiên, do thiếu các số liệu từ các thử nghiệm ngẫu nhiên về các tác dụng của thuốc lợi tiểu quai khí dung trên các kết quả lâm sàng quan trọng, sử dụng cách cho thuốc này thường quy và kéo dài không thể được đánh giá dựa trên bằng chứng hiện tại. Furosemide có thể giảm dịch chảy qua thành mạch trong mô kẽ thông qua các cơ chế không lợi tiểu. Những thay đổi này có thể được qua trung gian sự giải phóng prostaglandin E, có tác dụng giãn phế quản và giãn mạch phổi. Sự giải phóng prostaglandin E có thể giải thích sự liên quan của điều trị furosemide gây tăng nguy cơ còn ống động mạch.
Thiazide và các thuốc lợi tiểu giữa kali[sửa]
Chlorothiazide, một thuốc lợi tiểu mạnh đường uống, có vị trí tác dụng chính là đoạn gần của ống lượn xa bằng cách ức chế sự tái hấp thụ của chlor. Hơn nữa, thuốc giảm sự bài tiết calci từ thận so với các thuốc lợi tiểu quai. Spironolactone, thuốc lợi tiểu giữ kali, cạnh tranh với aldosterone ở ống lượn xa. Do đặc tính tác dụng của aldosterone, phụ thuộc vào sự tổng hợp protein, khởi phát tác dụng của spironolactone chậm. Khi kết hợp, các thuốc này tăng sự bài tiết natri, kali và phospho qua nước tiểu trong khi làm giảm bài tiết calci qua nước tiểu. Liều thông thường của chlorothiazide và spironolactone là 10 đến 20 mg/kg và 1 đến 2 mg/kg, tương ứng. Sự kết hợp này, cho đường uống, cho kết quả cải thiện chức năng phổi ở những bệnh nhân bị bệnh phổi mạn tính. Rối loạn điện giải (đặc biệt giảm kali và phospho) có thể xảy ra; như vậy, cần phải theo dõi các chất điện giải này. Vì những báo cáo về các biến chứng thần kinh nặng khi sử dụng steroid toàn thân, điều trị lợi tiểu được xem như là điều trị đầu tiên cho bệnh phổi mạn giai đoạn sớm. Chỉ định kéo dài thiazide-spironolactone dẩn đến chức năng phổi cải thiện và giảm sự cần thiết dùng furosemide cho các trẻ sơ sinh lớn hơn 3 tuần tuổi bị bệnh phổi mạn. Hơn nữa, thiazide-spironolactone có thể giảm nguy cơ tử vong và giảm tỷ lệ đặt nội khí quản liên tục trên 8 tuần ở những trẻ sơ sinh không có điều trị corticosteroid, các thuốc giãn phế quản hoặc aminophylline.
STEROID[sửa]
Corticosteroid đã được thử nghiệm trong ba nhóm bệnh lý hô hấp khác nhau ở sơ sinh: bệnh màng trong cấp, thở rít sau rút ống nội khí quản và bệnh phổi mạn phát triển. Thuốc đã không được chứng minh có ích trong điều trị bệnh màng trong ở trẻ sơ sinh. Steroid có thể có ích làm giảm phù thanh môn và dưới thanh môn trong các thử nghiệm rút nội khí quản. Tạp chí Cochrane đã kết luận rằng dexamethasone giảm nhu cầu đặt nội khí quản lại sau một giai đoạn thông khí cơ học. Tuy nhiên, tạp chí cũng cảnh báo rằng các tác dụng phụ của thuốc, sự sử dụng dexamethasone cần phải được hạn chế ở những bệnh nhân tăng nguy cơ tắc nghẽn và phù nề đường thở, như những bệnh nhân được đặt nội khí quản lặp lại hoặc kéo dài. Cho dù sự sử dụng corticosteroid trước sinh và điều trị surfactant sau sinh, tỷ lệ bệnh phổi mạn tính đã gia tăng. Hai điểm kết hợp có thể đề nghị sự giải thích một phần cho sự gia tăng tỷ lệ của bệnh phổi mạn tính: tỷ lệ mắc phải bệnh phổi mạn tính có liên quan nghịch với trọng lượng lúc sinh và tuổi thai, và sự sống của các trẻ sơ sinh có trọng lượng lúc sinh cực thấp đã tăng. Steroid đã được sử dụng rộng rãi trong điều trị bệnh phổi mạn tính của trẻ đẻ non, cũng được gọi là loạn sản phổi. Bệnh phổi mạn tính là biến chứng thường gặp được thấy ở những bệnh nhân sống tại phòng săn sóc tích cực sơ sinh, và tình trạng viêm đóng một vai trò quan trọng trong sinh bệnh học của bệnh. Điều trị bằng corticosteroid là một điều trị hấp dẩn do các đặc tính kháng viêm mạnh của thuốc. Glucocorticosteroid có nửa đời tương đối dài (cortisol 8 đến 12 giờ; prednisone 12 đến 36 giờ; dexamethasone 36 đến 72 giờ). Các thuốc này được chuyển hóa ở gan thành các hợp chất bất hoạt được bài tiết qua thận. Điều trị liều cao dexamethasone hoặc prednisone có kết quả giảm nhanh chóng nhu cầu O2 và các cài đặt máy thở và cải thiện sự đàn hồi phổi và sự trao đổi khí trong hơn nữa số bệnh nhân được điều trị. Trong hầu hết các trường hợp, sự cải thiện xảy ra trong 5 ngày điều trị đầu tiên. Tác dụng tích cực chính là rút ngắn thời gian rút ống nội khí quản từ 1 đến 3 tuần. Corticosteroid toàn thân có các tác dụng phụ mạnh bao gồm hạ đường huyết, tăng huyết áp, bệnh cơ tim tắc nghẽn phì đại, thủng và xuất huyết đường tiêu hóa, chậm phát triển và ức chế trục dưới đồi-tuyến yên-thượng thận. Các nghiên cứu ở súc vật cũng đã chứng minh steroid có thể ảnh hưởng lâu dài sự phân chia tế bào não, sự biệt hóa và sự myelin hóa, cũng như sự phát triển vỏ não. Các nghiên cứu theo dõi ở người cũng thêm vào nguyên nhân để cảnh báo. Những trẻ sơ sinh đã được cho dexamethasone 12 giờ sau sinh đã chứng tỏ có sự gia tăng gấp hai lần sự tổn thương thần kinh vận động so với nhóm chứng lúc 2 tuổi. Thời gian bắt đầu điều trị là một vấn đề phân tích của Cochrane, đã thực hiện một loại các phân tích meta về liệu pháp corticosteroid tiến hành vào ba thời điểm khác nhau: sớm (<96 giờ ở những trẻ sơ sinh có nguy cơ), sớm vừa phải (7 đến 14 ngày ở những trẻ sơ sinh có nguy cơ) và muộn (> 3 tuần). Ở thời điểm sớm, nghiên cứu meta đã chứng minh các lợi ích liên quan đến rút ống nội khí quản sớm, giảm các nguy cơ của bệnh phổi mạn tính, tử vong hoặc bệnh phổi mạn tính lúc 28 ngày tuổi, còn ống động mạch và các dò khí phổi. Xuất huyết tiêu hóa và thủng ruột là các tác dụng phụ quan trọng vào thời điểm này. Quan trọng hơn, người ta thấy nhiều các tác dụng phụ thần kinh khi khám theo dõi các trẻ sơ sinh được điều trị bằng liệu pháp steroid sớm: các triệu chứng thần kinh bất thường, bại não và chậm phát triển. Các kết quả khi chỉ định vào thời điểm sớm vừa phải (7 đến 14 ngày) đã chứng minh hầu hết các tác dụng tích cực được thấy vào thời điểm sớm. Chỉ một nghiên cứu theo dõi nhỏ được thực hiện vào thời điểm này đã không phát hiện bất kỳ sự tăng về tác dụng phụ về thần kinh. Vào thời điểm muộn hơn, steroid đã không làm giảm tỷ lệ tử vong, bệnh phổi lúc 36 tuần hoặc nhu cầu cần điều trị cấp cứu muộn bằng dexamethasone. Do những quan tâm về các hậu quả thần kinh, chúng tôi điều trị steroid cho trẻ sơ sinh 12 đến 14 ngày không được cai máy thở tích cực. Thời gian điều trị ngắn 7 ngày, bao gồm 0,25 mg/kg/liều mỗi 12 giờ trong 4 ngày tiếp theo bằng 0,05 mg/kg/liều mỗi 12 giờ trong 3 ngày. Sau đó ngưng điều trị. Nếu bệnh nhân biểu hiện tăng đáng kể các thông số máy thở sau khi ngưng điều trị steroid, điều trị được bắt đầu lại và thời gian bắt đầu giảm liều lâu hơn. Steroid dạng hít là cách hấp dẩn để cản trở các đợt viêm của bệnh phổi mạn tính trong khi giảm thiểu các tác dụng phụ và bệnh tật lâu dài.Ngày nay, steroid dạng hít đã chứng tỏ giảm nhu cầu steroid đường toàn thân nhưng đã không chứng minh có sự giảm tỷ lệ mắc phải bệnh phổi mạn tính. Mặc dù không có một nghiên cứu đặc biệt nào chứng tỏ lợi ích rõ ràng so với steroid toàn thân, steroid dạng hít là một liệu pháp hấp dẩn đối với bệnh phổi mạn tính. Liều lượng chính xác, thời gian bắt đầu điều trị, thuốc, quá trình và khả năng kết hợp với steroid toàn thân cần được làm sáng tỏ trước khi cách cho thuốc này thay thế steroid toàn thân.
CÁC THUỐC KÍCH THÍCH HÔ HẤP[sửa]
Các thuốc kích thích hô hấp có thể có ích trong điều trị cơn ngưng thở của trẻ đẻ non. Sau khi đánh giá và điểu trị những bệnh nhân này những bệnh lý kèm theo đặc hiệu, chữa được như là nhiễm trùng hoặc hạ đường huyết, các phác đồ điều trị ngưng thở thường bao gồm kích thích xúc giác, giảm nhiệt độ môi trường xung quanh, thở áp lực dương liên tục (CPAP) hoặc thông khí ngắt quãng bắt buộc (IMV). Một số bệnh nhân đáp ứng thuận lợi với các thuốc kích thích hô hấp như một điều trị đơn độc hoặc phối hợp. Trong thực hành, quyết định chỉ định thuốc kích thích hô hấp phụ thuộc vào mức độ nặng của cơn ngưng thở và đáp ứng của bệnh nhân với các can thiệp khác. Nếu cơn ngưng thở nặng và thường xảy ra, thường thiết lập thông khí hổ trợ đầu tiên. Khi cơn ngưng thở ít nặng, thuốc kích thích hô hấp có thể được sử dụng mà không cần đến thông khí cơ học.
Đôi khi, những trẻ bị bệnh màng trong có cơn ngưng thở tái phát trong khi cố gắng cai thông khí hổ trợ. Một số cai hiệu quả nhanh hơn trong khi được điều trị bằng các thuốc kích thích hô hấp. Cai hổ trợ hô hấp bằng cách sử dụng các thuốc kích thích hô hấp đã được báo cáo ở số lượng nhỏ trẻ bị bệnh màng trong và ở những trẻ đang được cài thông khí thấp. Lợi ích của việc sử dụng theophylline dự phòng để giảm tỷ lệ suy hô hấp sau rút ống nội khí quản và nhu cầu đặt lại nội khí quản đã được chứng minh trong một nghiên cứu trước đây, nhưng một phân tích meta gần đây hơn trong y văn không thể chứng minh hiệu quả về mặt này. Tuy nhiên, ở những trẻ đẻ non hậu phẫu, caffeine dường như dự phòng ngưng thở/nhịp tim chậm và các cơn giảm bão hòa oxy.
Các methylxanthine theophylline và caffeine là những thuốc kích thích hô hấp thường được sử dụng nhất. Những thuốc này tăng sự nhạy cảm của các receptor hóa học với carbon dioxide và tăng sức mạnh co bóp của cơ hoành. Hai thuốc này có thể không có chính xác cùng cơ chế tác dụng. Thể tích khí lưu thông dường như được tăng nhờ theophylline nhưng thuốc có tác dụng tối thiểu trên tần số hô hấp. Ngược lại, chính tần số hô hấp, chứ không phải thể tích khí lưu thông, được tăng nhờ caffeine. Các liều thông thường của các methylxanthine được liệt kê trong bảng 7. Các tác dụng sinh hóa và sinh lý của các xanthine được liệt kê trong bảng 8.
| BẢNG 7. Các Methylxanthine điều trị ngưng thở sơ sinh | ||||
|---|---|---|---|---|
| Thuốc | Liều tải (TM, mg/kg) | Liều duy trì (TM)* | Nồng độ plasma | Tính độc |
| Theophylline | 5,5-6,0 | 1 mg/kg mỗi 8 giờ hoặc 2 mg/kg mỗi 12 giờ | 7-20 (-10 lý tưởng) | Tim mạch: tim nhanh. Kích thích HTK TW: co giật, bồn chồn. Tiêu hóa: nôn mửa, chướng bụng |
| Caffeine | 10 | 2,5-5 mg/kg mỗi 24 giờ | 7-20 | Không xảy ra với nồng độ trong huyết tương < 50 mg/L |
| Caffeine citrate | 20 | 5-10 mg/kg mỗi 24 giờ | Như caffeine | |
- Liều đường uống = liều tĩnh mạch x 1,25
| BẢNG 8. Các tác dụng của các Xanthine |
| Sinh hóa |
| Ức chế phosphodiesterase |
| Đối kháng Adenosine trung tâm |
| Tăng luồng calci qua màng bao cơ |
| Sinh lý |
| Tăng thông khí phút |
| Hiệu quả co bóp cơ hoành mạnh hơn |
| Cải thiện cơ học phổi |
Theophylline[sửa]
Theophylline (1,3-dimethylxanthine) có nửa đời xấp xỉ 30 giờ. Ở người trưởng thành, theophylline được bài tiết nhờ biến đổi sinh học tại gan và bài tiết qua nước tiểu. Ở trẻ sơ sinh, tuy nhiên, sự biến đổi sinh học ở gan nhờ N-demethyl hóa không có, thay vào đó N-7-methyl hóa tạo ra caffeine. Nồng độ huyết tương điều trị khoảng 7 đến 20 mg/L. Trong một nghiên cứu, nồng độ lớn hơn 6,6 mg/L kiểm soát được các cơn ngưng thở, trong khi độc tính tim mạch như tim nhanh đã được ghi nhận chỉ với nồng độ lớn hơn 13,0 mg/L. Một số trẻ sơ sinh biểu hiện độc tính ở nồng độ 9,0 mg/L do theophylline mắc phải qua nhau. Nồng độ mong muốn đạt là 10 mg/L. Các dấu hiệu của ngộ độc bao gồm dễ kích thích, toát mồ hôi, tiêu chảy, co giật, trào ngược dạ dày thực quản và tim nhanh. Liều tải tĩnh mạch thông thường của theophylline là 4,0 đến 6,0 mg/kg, với liều duy trì 1 mg/kg mỗi 8 giờ hoặc 2 mg/kg mỗi 12 giờ. Nồng độ trong huyết thanh phải được đánh giá 48 đến 72 giờ sau khi bắt đầu liều duy trì.
Caffeine[sửa]
Caffeine (1,3,7-trimethylxanthine) có nửa đời huyết thanh khoảng 100 giờ ở trẻ sơ sinh. Nửa đời cực kỳ dài là do tốc độ bài tiết chậm. Ở người lớn, hầu hết caffeine được chuyển sang dạng xathine khử methyl (demethylated) và acid methyluric nhờ gan. Ở sơ sinh, tuy nhiên, hầu hết caffeine được bài tiết không thay đổi qua nước tiểu. Điều này có thể do thiếu hệ thống enzyme cytochrome P-450, chịu trách nhiệm chuyển hóa methylxanthine. Nồng độ huyết thanh điều trị khoảng 8 đến 20 mg/L. Nồng độ thấp 3 đến 4 mg/L kiểm soát được cơn ngưng thở và không có độc tính tim mạch, HTKTW hoặc đường tiêu hóa được ghi nhận khi nồng độ lên đến 50 mg/L. Liều tấn công thông thường của caffeine là 10 mg/kg, với liều duy trì hàng ngày 2,5 đến 5 mg/kg. (Dạng thông thường của caffeine, dung dịch citrate 20 mg/mL, tương đương với dung dịch căn bản 10 mg/mL). Các biểu hiện độc tính của những thuốc này liên quan đến hoạt động của mỗi loại thuốc trên những vị trí khác nhau. Theophylline có nhiều hoạt tính trên tim mạch hơn HTKTW. Do đó, các dấu hiệu ngộ độc sớm có nguồn gốc tim mạch, tiếp theo là co giật. Caffeine có nhiều tác dụng đáng kể trên HTKTW hơn so với tim mạch nhưng độc tính hiếm khi được thấy vì nồng độ cần để biểu hiện ngộ độc là cực kỳ cao. Vì những đặc điểm điều trị tương tự kết hợp với ít độc tính hơn, chúng tôi thích sử dụng caffeine hơn như một thuốc kích thích hô hấp đầu tay.
CÁC THUỐC KHÍ DUNG[sửa]
Các thuốc khí dung có lợi về mặt lý thuyết cách cho thuốc trực tiếp đến đường thở và phổi, thường cần với liều nhỏ và ít các tác dụng phụ hơn khi so sánh với liệu pháp tĩnh mạch hoặc đường uống. Tuy nhiên, cách cho thuốc khí dung vẫn là một nổ lực rất phức tạp. Những vấn đề đó là các yếu tố liên quan bệnh nhân, các đặc tính của thuốc (kích thước hạt, hình dạng, đậm độ), dụng cụ tạo khí dung hiệu quả nhất (máy khí dung, bình hít định liều nén áp suất), dụng cụ cho thuốc (mặt nạ, ống nội khí quản) và liều thuốc cần được đánh giá đầy đủ.
Các yếu tố liên quan người bệnh[sửa]
Giải phẫu phổi của trẻ sơ sinh (kích thước đường thở, thở bằng mũi, phát triển của phổi), sinh lý (kiểu thở, thể tích khí lưu thông, cơ học phổi) và sinh lý bệnh (sự viêm, chất nhầy, xẹp phổi, sự xơ hóa) thể hiện nhiều thách thức đến cách cho thuốc khí dung đến đường thở xa so với người lớn. Các yếu tố liên quan đến bệnh nhân thường đòi hỏi bác sỹ sử dụng các chiến lược sau đây để đưa thuốc đầy đủ cho trẻ sơ sinh: tăng số lượng khí dung, sử dụng các kỹ thuật tỉ mỉ để cho khí dung và cung cấp thở chậm hơn với thể tích khí thở vào lớn hơn qua mặt nạ hoặc ống nội khí quản trong quá trình đưa khí dung.
Các yếu tố iên quan khí dung[sửa]
Các đặc tính khí dung bao gồm kích thước hạt, hình dạng, độ nhớt và đậm độ. Một trong những đặc tính này, kích thước hạt có lẽ là yếu tố quan trọng nhất. Các hạt từ 2 đến 6 µm kết tủa trong đường thở trung tâm. Những hạt nhỏ hơn, ít đậm độ hơn có nhiều khả năng hơn để phân bố đến các đường thở ngoại vi và các vùng xa của phổi, do đó đến được các receptor phổi mong muốn hoặc được hấp thu đường toàn thân. Hệ thống đưa khí dung là yếu tố quan trọng tiếp theo để đảm bảo cách cho thuốc đầy đủ khi sử dung đường hô hấp.
TÀI LIỆU THAM KHẢO[sửa]
- Assisted Ventilation of the Neonate. Fourth Edition. 2003. Jay P. Glodsmith, MD; Edward H. Karotkin, MD. Sauders
XEM THÊM[sửa]
- Bệnh màng trong
- Đánh giá chức năng phổi sơ sinh
- Tăng áp phổi tồn tại sơ sinh
- Nhi khoa
- Sơ sinh
- Dịch và các chất điện giải trẻ Sơ sinh
- Lịch Tiêm chủng
- Vàng da Sơ sinh
- Vàng da tăng bilirubin máu